Rajasthan Board RBSE Class 11 Chemistry Chapter 4 रासायनिक आबंधन तथा आण्विक संरचना
RBSE Class 11 Chemistry Chapter 4 पाठ्यपुस्तक के अभ्यास प्रश्न
RBSE Class 11 Chemistry Chapter 4 वस्तुनिष्ठ प्रश्न
प्रश्न 1.
PCl5 का अस्तित्व है किन्तु NCl5 का नहीं, क्योंकि –
(अ) नाइट्रोजन में रिक्त d – कक्षक नहीं होते हैं।
(ब) नाइट्रोजन की आयनन ऊर्जा बहुत अधिक होती है।
(स) नाइट्रोजन का परमाणु क्लोरीन के समान नहीं होता है।
(द) उपरोक्त में से कोई नहीं।
प्रश्न 2.
निम्न में से किसका द्विध्रुव आघूर्ण शून्य होता है –
(अ) ClF
(ब) PCl3
(स) SiF4
(द) CFCl3
प्रश्न 3.
N2 अणु की आबंध कोटि है –
(अ) 3
(ब) 2
(स) 1
(द) 0
प्रश्न 4.
निम्न में से किस अणु में एक अयुग्मित इलेक्ट्रॉन पाया जाता है –
(अ) NO
(ब) CO
(स) NH3
(द) O2
प्रश्न 5.
निम्न में से कौनसा अणु/आयन sp’ संकरण दिखाता है –
(अ) BF3 और NH2-
(ब) NO2- और NH3
(स) BF3 और NO2-
(द) NH2- और H2O
उत्तरमाला:
1. (अ)
2. (स)
3. (अ)
4. (अ)
5. (स)
RBSE Solutions for Class 11 Chemistry Chapter 4 अतिलघूत्तरात्मक प्रश्न:
प्रश्न 6.
निम्नलिखित परमाणुओं तथा आयनों के लुइस बिन्दु प्रतीक लिखिए S, S2-, Ar तथा Al3+.
उत्तर
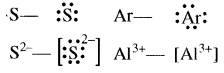
प्रश्न 7.
Li2 अणु का इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
Li2 अणु का इलेक्ट्रॉनिक विन्यास निम्न है – (σ 1s)2 (σ*1s)2 (σ2s)2 या KK (σ2s)2
प्रश्न 8.
आबंध सामर्थ्य को आबंध कोटि के रूप में आप किस प्रकार व्यक्त करेंगे?
उत्तर:
आबंध कोटि बढ़ने पर आबंध सामर्थ्य बढ़ती है क्योंकि आबंध ऊर्जा का मान बढ़ता है।
प्रश्न 9.
N2, O2, Cl2 तथा F2, को बढ़ती आबंध ऊर्जा के क्रम में व्यवस्थित कीजिए।
उत्तर:
इन अणुओं की आबंध ऊर्जा का बढ़ता क्रम निम्न प्रकार है – F2 < Cl2 < O2 < N2
प्रश्न 10.
CO32- आयन के सन्दर्भ में अनुनाद को समझाइए।
उत्तर:
CO32- आयन में अनुनाद के कारण तीनों C – O ओबन्ध लम्बाई समान होती है तथा बन्ध क्रम का मान 1.33 होता है।
प्रश्न 11.
निम्नलिखित अणुओं में केन्द्रीय परमाणु का संकरण बताइए – CCl4, H2O, SO2, CO2
उत्तर:
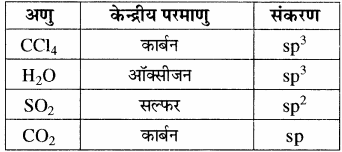
प्रश्न 12.
कमरे के ताप पर H2O द्रव है, क्यों?
उत्तर:
H2O में ऑक्सीजन की विद्युतऋणता अधिक होने के कारण अणुओं के मध्य प्रबल अन्तराणुक हाइड्रोजन बन्ध पाया जाता है। इसलिए जल के अणु पास – पास आ जाते हैं अतः कमरे के ताप पर H2O द्रव है।
प्रश्न 13.
आयनिक यौगिकों के क्वथनांक और गलनांक उच्च होते हैं। क्यों?
उत्तर:
आयनिक यौगिकों में आयनों के मध्य प्रबल स्थिर वैद्युत आकर्षण बल पाया जाता है, जिसे तोड़ने के लिए अधिक ऊर्जा की आवश्यकता होती है अतः इनके क्वथनांक और गलनांक उच्च होते हैं।
प्रश्न 14.
AlCl3 का अणु सहसंयोजी होता है जबकि AlF3 आयनिक होता है, क्यों?
उत्तर:
AlCl3 में Cl- का आकार AlF3 के F– की तुलना में बड़ा होता है अतः Al3+ द्वारा इसका ध्रुवण आसानी से हो जाता है। इस कारण AlCl3 का अणु सहसंयोजी होता है जबकि AlF3 आयनिक होता है।
प्रश्न 15.
SO3 तथा NO2 अणुओं की अनुनाद संरचनाएँ लिखिए।
उत्तर:
SO3 तथा NO2 अणुओं की अनुनाद संरचनाएँ निम्न हैं –
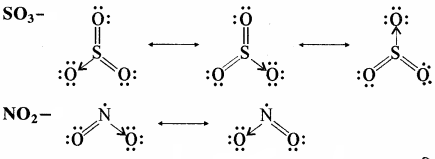
प्रश्न 16.
X – अक्ष को अन्तर्नाभिकीय अक्ष मानते हुए बताइए कि निम्नलिखित में कौनसे कक्षक सिग्मा आबंध नहीं बनाएंगे।
(अ) 1s तथा 1s
(ब) 1s तथा 2Px
(स) 2Py तथा 2Py
(द) 1s तथा 2s
उत्तर:
(ब) 1s तथा 2Px
(स) 2Py तथा 2Py
कक्षक सिग्मा आबंध नहीं बनाएंगे।
प्रश्न 17.
निम्न में से किसकी ध्रुवण शक्ति उच्चतम होगी – Na+, K+, Li+, Cs+
उत्तर:
इन आयनों में से Li+ की ध्रुवण शक्ति उच्चतम होगी क्योंकि इसका आकार सबसे छोटा है।
प्रश्न 18.
सिल्वर हैलाइडों की जल में विलेयता को बढ़ते क्रम में व्यवस्थित कीजिए।
उत्तर:
सिल्वर हैलाइडों की जेल में विलेयता का बढ़ता क्रम निम्न प्रकार होता है –
AgI < AgBr < AgCl < AgF
प्रश्न 19.
NaCl एक आयनिक यौगिक है जबकि CuCl एक सहसंयोजक यौगिक है। कारण बताइए।
उत्तर:
Na+ [(2, 8), अक्रिय गैस विन्यास] की तुलना में Cu+ (2, 8, 18 छद्म अक्रिय गैस विन्यास) की ध्रुवण क्षमता अधिक है। अतः Cu+, ऋणायन (Cl–) का ध्रुवण अधिक करेगा, इसी कारण NaCl एक आयनिक यौगिक है जबकि CuCl एक सहसंयोजक यौगिक है।
प्रश्न 20.
निम्नलिखित अभिक्रिया में Al– परमाणु की संकरण अवस्था में परिवर्तन को समझाइए –
AlCl3 + Cl– → AlCl4–
उत्तर:
AlCl3 में Al पर sp2 संकरण होता है (3σ बन्ध) लेकिन AlCl4– में Al पर sp3 संकरण होता है (4σ बन्ध)।
RBSE Solutions for Class 11 Chemistry Chapter 4 लघूत्तरात्मक प्रश्न:
प्रश्न 21.
अष्टक नियम को परिभाषित कीजिए तथा इस नियम के महत्त्व और सीमाओं को लिखिए।
उत्तर:
अष्टक नियम (रासायनिक आबन्धन का इलेक्ट्रॉनिकी सिद्धान्त) – परमाणुओं के मध्य बन्ध बनते समय इलेक्ट्रॉनों का एक परमाणु से दूसरे परमाणु पर स्थानान्तरण या साझा होता है। इसमें परमाणु अपने संयोजकता कोश का अष्टक पूर्ण करते (आठ इलेक्ट्रॉन) हैं, इसे अष्टक का नियम कहते हैं। अष्टक का नियम मुख्य रूप से द्वितीय आवर्त के तत्वों पर लागू होता है तथा यह कार्बनिक यौगिकों की संरचना समझने में उपयोगी है। इसके अपवाद (सीमाएँ) निम्न हैं –
- केन्द्रीय परमाणु का अपूर्ण अष्टक (आठ से कम इलेक्ट्रॉन) – इनमें केन्द्रीय परमाणु के संयोजकता इलेक्ट्रॉनों की संख्या चार से कम होती है अतः यौगिक के केन्द्रीय परमाणु के चारों ओर इलेक्ट्रॉनों की संख्या 8 से कम होती है।
- विषम इलेक्ट्रॉन अणु-इन अणुओं में विषम संख्या में इलेक्ट्रॉन होते हैं, जैसे – NO (15e) (नाइट्रिक ऑक्साइड), NO2 (23e) (नाइट्रोजन डाइऑक्साइड) इनमें सभी परमाणु अष्टक के नियम का पालन नहीं करते।

- प्रसारित अष्टक (केन्द्रीय परमाणु पर आठ से अधिक इलेक्ट्रॉन युक्त यौगिक) – इनमें 3s तथा 3p के अतिरिक्त 3d कक्षक भी बन्ध बनाने के लिए उपलब्ध होते हैं। ऐसा तीसरे तथा इसके आगे के आवर्त के तत्वों में होता है।
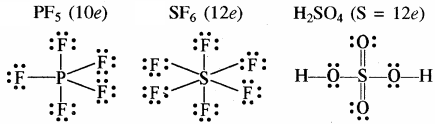
- अष्टक नियम, उत्कृष्ट गैसों की रासायनिक अक्रियता पर आधारित है लेकिन इनक्रे कुछ यौगिक जैसे – XeF2, KrF2, तथा XeOF2 इत्यादि बनते हैं।
- यह अणु की आकृति स्पष्ट नहीं करता।
- यह अणुओं के स्थायित्व तथा ऊर्जा की व्याख्या नहीं करता।
प्रश्न 22.
निम्न युग्मों में से कौन अधिक सहसंयोजक है और क्यों?
(अ) CuO तथा Cus
(ब) AgCl तथा AgI
(स) PbCl2 तथा PbCl4
(द) NaCl तथा CuCl
उत्तर:
(अ) CuO तथा CuS में CuS अधिक सहसंयोजक है। क्योंकि इसमें S-2 के बड़े आकार के कारण इसका ध्रुवण आसानी से हो जाता है।
(ब) AgCl तथा AgI में Agl अधिक सहसंयोजक है क्योंकि I – के बड़े आकार के कारण इसका ध्रुवण आसानी से हो जाता है।
(स) PbCl2 तथा PbCl4 में PbCl4 अधिक सहसंयोजक है। क्योंकि इसमें Pb अधिक धनावेशित (Pb+4) है अतः यह ऋणायन का ध्रुवण अधिक करता है।
(द) NaCl तथा CuCl में CuCl अधिक सहसंयोजक है। क्योंकि Cu+ में छद्म अक्रिय गैस विन्यास (बाह्यतम कोश में 18e) है अतः इसकी ध्रुवण क्षमता अधिक है।
प्रश्न 23.
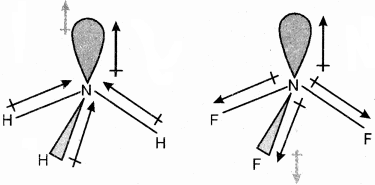
NH3 तथा NF3 में से किस अणु का द्विध्रुव आघूर्ण अधिक है और क्यों?
उत्तर:
NH3 तथा NF3 दोनों अणुओं की आकृति पिरामिडीय होती है, जिनमें नाइट्रोजन परमाणु पर एक एकाकी इलेक्ट्रॉन युग्म है। फ्लुओरीन की विद्युत् ऋणात्मकता नाइट्रोजन की अपेक्षा अधिक होती है लेकिन नाइट्रोजन की विद्युत् ऋणात्मकता हाइड्रोजन से अधिक होती है। परंतु NH3 का परिणामी द्विध्रुव आघूर्ण NF3 के द्विध्रुव आघूर्ण की अपेक्षा अधिक होता है। क्योंकि NF3 में नाइट्रोजन परमाणु पर उपस्थित एकाकी इलेक्ट्रॉन युग्म का कक्षक द्विध्रुव आघूर्ण तीन N – F आबंधों के द्विध्रुव – आघूर्गों के परिणामी द्विध्रुव – आघूर्ण की विपरीत दिशा में होता है। अतः कक्षक द्विध्रुव आघूर्ण, एकाकी इलेक्ट्रॉन युग्म के कारण N – F आबंध-आघूर्गों के परिणामी द्विध्रुव – आघूर्ण के प्रभाव को कम कर देता है। इसके कारण NF3 के अणु का द्विध्रुव आघूर्ण कम हो जाता है। जबकि NH3 में कक्षक द्विध्रुव आघूर्ण तथा तीन N – H आबन्धों के परिणामी द्विध्रुव आघूर्ण की दिशा समान होती है। अतः ये दोनों एक – दूसरे के प्रभाव को कम नहीं करते हैं।
प्रश्न 24.
सिग्मा तथा पाई आबन्ध में अन्तर स्पष्ट कीजिए।
उत्तर:
सिग्मा (σ) आबन्ध:
वह सहसंयोजी आबन्ध जो कक्षकों के अन्तर्नाभिकीय अक्ष पर अक्षीय (Head on या axial) अतिव्यापन से बनता है, उसे σ आबन्ध कहते हैं।
पाई (π) आबन्ध:
कक्षकों के सम्पार्श्विक अतिव्यापन से बने बन्ध को π आबन्ध कहते हैं। इसमें कक्षकों के अक्ष एक – दूसरे के समानान्तर तथा अन्तर्नाभिकीय अक्ष के लम्बवत् होते हैं। सिग्मा आबन्ध, π आबन्ध की तुलना में प्रबल होता है क्योंकि σ आबन्ध में अतिव्यापन की मात्रा, π आबन्ध की तुलना में अधिक होती है। π आबन्ध हमेशा σ आबन्ध के साथ ही पाया जाता है।
आबन्ध की प्रबलता α अतिव्यापन की सीमा
प्रश्न 25.
परमाणु कक्षकों के रेखीय संयोग से आणविक कक्षक बनने के लिए कौन – कौन सी शर्ते आवश्यक हैं? बताइए।
उत्तर:
परमाणु कक्षकों के रेखीय संयोग से आण्विक कक्षकों के बनने के लिए आवश्यक शर्ते निम्न हैं –
- संयोग करने वाले परमाणु कक्षकों की ऊर्जा समान या लगभग समान होनी चाहिए। इसका अर्थ यह है कि समनाभिकीय द्विपरमाणुक अणुओं (H2, O2) में एक 1s कक्षक दूसरे 1s कक्षक से संयोग कर सकता है परंतु 2s कक्षक से नहीं, क्योंकि 2s कक्षक की ऊर्जा 1s कक्षक की ऊर्जा से अधिक होती है। विषमनाभिकीय अणुओं (HCl) में ऐसा हो सकता है।
- समान होनी चाहिए। परम्परा के अनुसार z – अक्ष को आण्विक अक्ष मानते हैं। इसके अनुसार समान या लगभग समान ऊर्जा वाले परमाणु कक्षक केवल तभी संयोग करेंगे, जब उनकी सममिति समान हो, अन्यथा नहीं। जैसे एक परमाणु का – 2pz कक्षक दूसरे परमाणु के 2pz कक्षक से संयोग करेगा, परंतु 2px या 2py कक्षकों से नहीं, क्योंकि उनकी सममिति समान नहीं है।
- संयोग करने वाले परमाणु कक्षकों के बीच अधिकतम अतिव्यापन होना चाहिए। कक्षकों के मध्य जितना अधिक अतिव्यापन होगा, आण्विक कक्षकों के नाभिकों के बीच इलेक्ट्रॉन – घनत्व उतना ही अधिक होगा, जिससे प्रबल बन्ध का निर्माण होगा।
प्रश्न 26.
He2+ आयन He2 अणु की तुलना में अधिक स्थायी है, क्यों?
उत्तर:
He2+ आयन में तीन इलेक्ट्रॉन होते हैं अतः इसका इलेक्ट्रॉनिक विन्यास (σ1s)2 (σ*1s)1 होगा तथा बन्ध क्रम \(\frac { 1 }{ 2 } \) = [2 – 1] = \(\frac { 1 }{ 2 } \) है। जबकि He2 का बन्ध क्रम शून्य होता है। अतः He2+ आयन He2 अणु की तुलना में अधिक स्थायी है।
प्रश्न 27.
HCl, H2O तथा NH3 में से किसका क्वथनांक सर्वाधिक होता है और क्यों?
उत्तर:
HCl, H2O तथा NH3 में से H2O का क्वथनांक सर्वाधिक होता है क्योंकि HCl में तो दुर्बल वान्डरवाल बल पाया जाता है तथा H2O में हाइड्रोजन बन्ध की प्रबलता NH3 में हाइड्रोजन बन्ध की तुलना में अधिक होती है अतः जल (H2O) के अणुओं में संगुणन अधिक होता है, जिसके कारण अणु अधिक पास आ जाते हैं जिन्हें दूर – दूर करने के लिए अधिक ऊर्जा की आवश्यकता होती है।
प्रश्न 28.
ClF3 अणु की आकृति को VSEPR सिद्धान्त के आधार पर समझाइए।
उत्तर:
ClF3 अणु में क्लोरीन परमाणु पर 3 बन्धित इलेक्ट्रॉन युग्म (b.p.) तथा दो एकाकी इलेक्ट्रॉन युग्म (1.p) होते हैं तथा यह T आकृति का होता है क्योंकि इसमें 1.p विषुवतीय स्थिति में उपस्थित है। इसलिए 1.p – 1.p प्रतिकर्षण कम होता है।
प्रश्न 29.
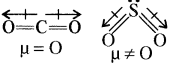
CO2 अणु का द्विध्रुव आघूर्ण शून्य जबकि SO2 अणु में द्विध्रुव आघूर्ण होता है। कारण समझाइए।
उत्तर:
CO2 तथा SO2 दोनों ही यौगिकों में ध्रुवीय बन्ध होते हैं। लेकिन CO2 की ज्यामिति रेखीय होती है, अतः इसके दोनों C – O बन्धों के बन्ध आघूर्ण एक – दूसरे के विपरीत दिशा में होने के कारण इनका प्रभाव निरस्त हो जाता है जिसके कारण इसका द्विध्रुव आघूर्ण शून्य होता है अतः CO2 अध्रुवीय है जबकि SO2 में ऐसा नहीं होता क्योंकि इसकी ज्यामिति कोणीय होती है अतः इसका द्विध्रुव आघूर्ण शून्य नहीं होता अर्थात् SO2 अणु में द्विध्रुव आघूर्ण होता है। अतः यह ध्रुवीय है।
प्रश्न 30.
BaSO4 आयनिक यौगिक होता है फिर भी जल में अविलेय होता है। क्यों?
उत्तर:
BaSO4 में ऋणायन (SO42-) का आकार बहुत बड़ा होता है अतः इसके लिए जलयोजन ऊर्जा का मान जालक ऊर्जा से कम होता है क्योंकि जलयोजन ऊर्जा का मान मुख्यतः धनायन के आकार पर निर्भर कर रहा है। यहाँ धनायन (Ba+2) का आकार अन्य क्षार धातुओं से अधिक है। इसी कारण BaSO4 आयनिक होते हुए भी जल में अविलेय होता है।
जलयोजन ऊर्जा ∝ \(\frac { 1 }{ { r }_{ + } } { + }\frac { 1 }{ { r }_{ – } } \)
प्रश्न 31.
आयनिक यौगिकों की विलेयता को प्रभावित करने वाले किन्हीं चार कारकों का उल्लेख कीजिए।
उत्तर:
विलेयता को प्रभावित करने वाले कारक:
- आयनिक यौगिक ऐसे विलायकों में घुलनशील होते हैं जिनके परावैद्युतांक (Dielectric constant) का मान उच्च होता है। परावैद्युतक, किसी आयनिक यौगिक के स्थिर वैद्युत आकर्षण बल को कम कर देता है। विलायक के परावैद्युतांक का मान बढ़ने पर आयनिक यौगिक की विलेयता बढ़ती है। जल का परावैद्युतांक उच्च (80) होने के कारण यह आयनिक यौगिकों के लिए अच्छा विलायक होता है।
- जालक ऊर्जा ∝ \(\frac { 1 }{ { r }_{ + }+{ r }_{ – } } \) धनायन की त्रिज्या स्थिर होने पर, जालक ऊर्जा का मान ऋणायन की त्रिज्या बढ़ने पर कम होता है। अतः जल में LiX की विलेयता का क्रम इस प्रकार होता है –
LiF < LiCl < LiBr < LiI - विलायकन ऊर्जा ∝ \(\frac { 1 }{ { r }_{ + } } { + }\frac { 1 }{ { r }_{ – } } \) ऋणायन की त्रिज्या स्थिर होने पर, विलायकन ऊर्जा का मान धनायन की त्रिज्या बढ़ने पर कम होता है। अतः क्षारीय मृदा धातुओं के सल्फेट जल में अपेक्षाकृत कम विलेय होते हैं लेकिन वर्ग में नीचे जाने पर इनकी विलेयता घटती जाती है।
BeSO4 > MgSO4 > CaSO4 > SrSO4 > BaSO4 (जल में विलेयता का घटता क्रम)
अन्य उदाहरण:
- क्षार धातुओं के हैलाइडों की जल में विलेयता वर्ग में नीचे जाने पर बढ़ती है।
LiCl < NaCl < KCl < RbCl < CsCl - आवर्त में हैलाइडों की जल में विलेयता कम होती है।
NaCl > MgCl2 > AlCl3 > SiCl4 - धातुओं के कार्बोनेट सामान्यतः जल में विलेय होते हैं तथा वर्ग में ऊपर से नीचे जाने पर इनकी जल में विलेयता बढ़ती है।
Na2CO3 < K2CO3 < Rb2CO3 < Cs2CO3 - क्षारीय मृदा धातुओं के कार्बोनेट तथा बाई कार्बोनेट अपेक्षाकृत जल में कम विलेय होते हैं लेकिन वर्ग में नीचे जाने पर इनकी विलेयता बढ़ती है।
प्रश्न 32.
ध्रुवीय सहसंयोजी आबंध से आप क्या समझते हैं? उदाहरण सहित व्याख्या कीजिए।
उत्तर:
ध्रुवीय सहसंयोजी आबन्ध:
किसी आबंध का सौ प्रतिशत आयनिक या सहसंयोजी होना एक आदर्श स्थिति है। परंतु वास्तव में कोई भी आबंध या यौगिक पूर्ण रूप से सहसंयोजी या आयनिक नहीं होता है। जब सहसंयोजी आबंध दो समान परमाणुओं के बीच (जैसे H2, O2, Cl2, N2, तथा F2) बनता है, तब संयोजी इलेक्ट्रॉन युग्म दोनों परमाणुओं द्वारा समान रूप से आकर्षित होता है। इससे इलेक्ट्रॉन युग्म दो समान नाभिकों के ठीक मध्य में स्थित होता है। इस प्रकार प्राप्त आबंध ‘अध्रुवीय सहसंयोजी आबंध’ कहलाता है। इसके विपरीत HF जैसे विषम परमाणुक अणु में दो परमाणुओं के बीच साझित इलेक्ट्रॉन युग्म अधिक विद्युत ऋणी परमाणु फ्लुओरीन की ओर विस्थापित हो जाता है। इस प्रकार के आबंध को ध्रुवीय सहसंयोजक आबंध कहते हैं।
प्रश्न 33.
निम्न में से किस यौगिक में क्रमशः दुर्बलतम और प्रबलतम हाइड्रोजन आबंध है – NH3, PH3, H2O, H2S
उत्तर:
इन यौगिकों में से PH3 में दुर्बलतम तथा H2O में प्रबलतम हाइड्रोजन आबन्ध होता है क्योंकि PH3 में P की विद्युत ऋणात्मकता कम होने के कारण इसमें अणुओं के मध्य हाइड्रोजन बन्ध नगण्य होता है जबकि H2O में O की विद्युत ऋणात्मकता अधिक होने के कारण इसमें प्रबल हाइड्रोजन बन्ध पाया जाता है।
प्रश्न 34.
आबंध लम्बाई को प्रभावित करने वाले कारकों को समझाइए।
उत्तर:
आबंध लम्बाई:
किसी अणु में आबंधित परमाणुओं के नाभिकों के बीच की साम्यावस्था दूरी को ‘आबंध लम्बाई’ कहते हैं। आबंध लम्बाई को सामान्यतः pm (पिकोमीटर) या Å (एंगस्ट्राम) में व्यक्त किया जाता है। इसे स्पेक्ट्रमी, एक्स – किरण विवर्तन तथा इलेक्ट्रॉन विवर्तन (Electron Diffraction) विधियों से ज्ञात किया जाता है।
किसी सहसंयोजी अणु (AB) में उपस्थित बन्ध की आबंध लम्बाई को निम्न प्रकार दर्शाया जाता है –
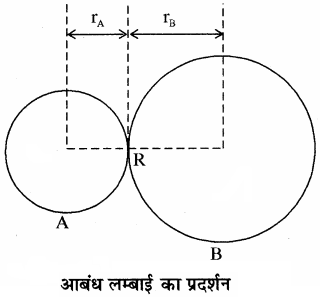
आबंध लम्बाई का प्रदर्शन आबंध लम्बाई (R) = rA +rB
rA = A की सहसंयोजी त्रिज्या
rB = B की सहसंयोजी त्रिज्या
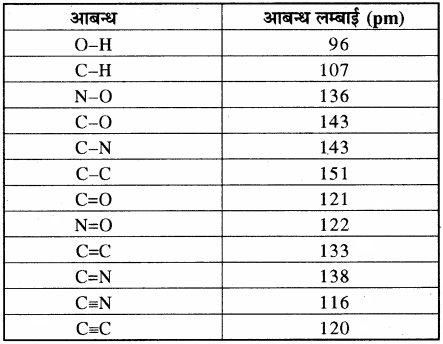
अतः दो बन्धित परमाणुओं के मध्य आबंध लम्बाई सामान्यतः दोनों बन्धित परमाणुओं की सहसंयोजी त्रिज्या के योग के बराबर होती है। मुख्य एकल, द्वि तथा त्रि आबंधों की औसत बन्ध लम्बाई नीचे सारणी में दी गयी है –
सारणी – मुख्य आबंधों की आबन्थ लम्बाई
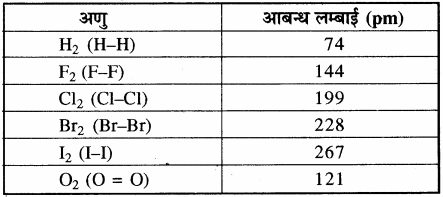
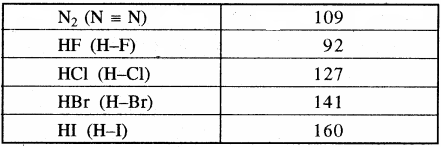
कुछ सामान्य अणुओं की आबंध लम्बाई नीचे सारणी में दी गयी है।
सारणी – कुछ सामान्य अणुओं की आबन्ध लम्बाइयाँ अणु
आबन्ध लम्बाई को प्रभावित करने वाले कारक:
आबन्ध लम्बाई निम्नलिखित कारकों पर निर्भर करती है –
- परमाणु आकार:
परमाणु आकार बढ़ने पर बन्ध लम्बाई बढ़ती है क्योंकि बन्धित परमाणुओं के नाभिकों के बीच की दूरी बढ़ती है।
उदाहरण:
F – F < Cl – Cl < Br – Br <I – I तथा HF < HCl < HBr < HI - विद्युत ऋणता में अन्तर:
दो बन्धित परमाणुओं की विद्युत ऋणता में अन्तर बढ़ने पर बन्ध लम्बाई कम होती है क्योंकि इससे बन्ध की ध्रुवता बढ़ती है। अतः परमाणुओं के मध्य आकर्षण बढ़ता है जिससे उनके नाभिक पासपास आ जाते हैं।
उदाहरण:
C – H > N – H > O – H > F – H (विद्युत ऋणता में अन्तर बढ़ रहा है।)
HI > HBr > HCl > HF - बन्ध – क्रम या आबन्ध कोटि:
दो परमाणुओं के मध्य बन्ध-क्रम या आबन्ध कोटि क्रम (बन्धों की संख्या) बढ़ने पर बन्ध लम्बाई कम होती है। क्योंकि बन्धों की संख्या बढ़ने पर, परमाणु पास – पास आते हैं जिससे उनके नाभिकों के बीच की दूरी कम हो जाती है।
बन्ध लम्बाई
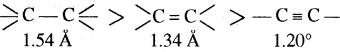
(बन्ध लम्बाई का घटता क्रम) - संकरण में s गुण:
संकरण में s गुण बढ़ने पर बन्ध लम्बाई कम होती है।
उदाहरण:
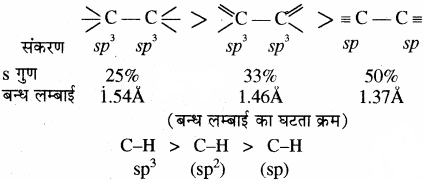
- अनुनाद:
अनुनाद के कारण एकल बन्ध में द्विबन्ध के तथा द्विबन्ध में एकल बन्ध के लक्षण आ जाते हैं अतः अनुनाद से एकल बन्ध की बन्ध लम्बाई कम हो जाती है तथा द्विबन्ध की बन्ध लम्बाई बढ़ जाती है।
उदाहरण:
बेन्जीन में अनुनाद के कारण सभी C – C बन्धों की बन्ध लम्बाई समान (1.39Å) होती है जो कि C – C एकल बन्ध (1.54Å) तथा C – C द्विबन्ध (1.34Å) के बीच की है।
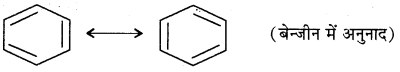
प्रश्न 35.
C2H2 अणु में C – C परमाणुओं के बीच त्रि-आबंध के निर्माण को चित्र सहित स्पष्ट कीजिए।
उत्तर:
C2H2 (HC = CH) (ऐसिटिलीन या एथाइन):
एथाइन में दोनों कार्बन sp संकरित अवस्था में होते हैं। इसमें प्रत्येक कार्बन की उत्तेजित अवस्था में (6C = 1s2 2s1 2px1 2py1 2pz1) एक s तथा एक p कक्षक आपस में मिलकर दो sp संकरित कक्षक बनाते हैं। तथा दोनों कार्बन परमाणु पर दो – दो असंकरित कक्षक (2py तथा 2px) उपस्थित रहते हैं। एक कार्बन परमाणु का sp संकर कक्षक दूसरे कार्बन परमाणु के sp संकर कक्षक से अक्षीय अतिव्यापन करके C – C सिग्मा आबंध बनाता है। शेष sp संकर कक्षक हाइड्रोजन के 1s कक्षकों के साथ अतिव्यापन करके सिग्मा आबंध बनाते हैं। दोनों कार्बन परमाणुओं पर उपस्थित दो – दो असंकरित कक्षक सम्पाश्विक अतिव्यापून द्वारा दो पाई – आबंध बनाते हैं। इस प्रकार एथाइन में दो कार्बन परमाणुओं के बीच त्रि-आबंध होता है (बन्ध लम्बाई 120 Pm) जिसमें एक सिग्मा तथा दो पाई आबंध होते हैं। C2H2 में भी प्रत्येक कार्बन रेखीय ज्यामिति दर्शाता है तथा बन्ध कोण 180° होता है। जिनका चित्रण निम्न प्रकार है –
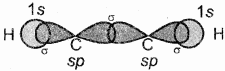
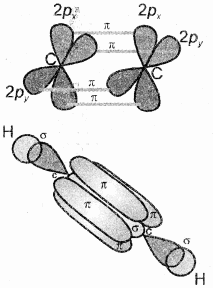
एथाइन में सिग्मा σ तथा π बन्ध के चारों ओर दोनों अक्षों पर दो पाई बन्ध के इलेक्ट्रॉन अभ्र बेलनाकार आकृति के रूप में पाये जाते हैं।
sp संकरण के अन्य उदाहरण निम्न है – CO, Hgl2, CdCl2, [Ag(CN)2]
RBSE Class 11 Chemistry Chapter 4 निबन्धात्मक प्रश्न
प्रश्न 36.
संयोजकता आबंध सिद्धान्त के आधार पर H2 – अणु के विरचन की व्याख्या कीजिए।
उत्तर:
संयोजकता आबन्ध सिद्धान्त:
संयोजकता आबन्ध सिद्धान्त सर्वप्रथम हाइटलर तथा लंडन (1927) ने दिया जिसका विकास पॉलिग इत्यादि ने किया। यह सिद्धान्त परमाणु कक्षकों, तत्त्वों के इलेक्ट्रॉनिक विन्यास, परमाणु कक्षकों के अतिव्यापन, संकरण तथा विचरण (Variation) एवं अध्यारोपण के सिद्धान्त पर आधारित है। यहाँ संयोजकता बन्ध सिद्धान्त के केवल गुणात्मक विवरण का ही वर्णन किया जाएगा।
संयोजकता आबन्ध सिद्धान्त के प्रमुख अभिगृहीत निम्नलिखित हैं –
- बन्ध बनाने वाले दो परमाणुओं के बाह्यतम कोश के वे कक्षक जिनमें अयुग्मित इलेक्ट्रॉन उपस्थित होते हैं, आपस में अतिव्यापन करके सहसंयोजी बन्ध का निर्माण करते हैं। लेकिन कक्षकों में उपस्थित अयुग्मित इलेक्ट्रॉनों का चक्रण विपरीत होना चाहिए।
- कक्षकों के मध्य अतिव्यापन से तंत्र की स्थितिज ऊर्जा कम हो जाती है अतः बनने वाले अणु का स्थायित्व, विलगित परमाणुओं की तुलना में अधिक होता है। लेकिन बंधित परमाणुओं की पहचान बनी रहती है।
- आद्य अवस्था (Ground State) में यदि किसी परमाणु के पास उपयुक्त संख्या में अयुग्मित इलेक्ट्रॉन उपस्थित नहीं हैं तो परमाणु के इलेक्ट्रॉन उत्तेजित होकर रिक्त कक्षकों में चले जाते हैं जिससे आवश्यक संख्या में अयुग्मित इलेक्ट्रॉन प्राप्त हो जाते हैं।
- बंधित परमाणुओं के कक्षकों के मध्य अतिव्यापन की मात्रा अधिक होने पर बनने वाला बन्ध अधिक प्रबल होता है।
- परमाणु कक्षकों के मध्य अतिव्यापन की मात्रा अतिव्यापन में भाग लेने वाले कक्षकों की प्रकृति (संकरित या असंकरित) तथा अतिव्यापन के प्रकार पर निर्भर होती है।
- जब किसी परमाणु के बाह्यतम कोश के अयुग्मित इलेक्ट्रॉन भिन्न – भिन्न कक्षकों में उपस्थित होते हैं, जिनकी ऊर्जा में अन्तर होता है। तो समान ऊर्जा के कक्षक बनाने के लिए इन कक्षकों का संकरण होता है।
- संकरित कक्षकों का दिशात्मक गुण अधिक होने के कारण इनके मध्य अतिव्यापन अधिक होता है। अतः अपेक्षाकृत अधिक प्रबल बन्ध बनते हैं।
- कुछ यौगिकों के अणुओं को केवल एक लुइस संरचना द्वारा नहीं दर्शाया जा सकता है अतः उनमें अनुनाद होता है जिसके कारण अणु का स्थायित्व बढ़ता है।
संयोजकता बन्ध सिद्धान्त से सरलतम अणु (H2) के विरचन की व्याख्या –
माना कि हाइड्रोजन के दो परमाणु A व B, जिनके नाभिक क्रमशः NA व NB हैं तथा उनमें उपस्थित इलेक्ट्रॉन eA और eB हैं। जब ये दोनों परमाणु एक – दूसरे से बहुत अधिक दूरी पर होते हैं, तो उनके बीच कोई अन्योन्य क्रिया (Interaction) नहीं होती। ज्यों – ज्यों दोनों परमाणु एक – दूसरे के पास आते हैं, त्यों – त्यों उनके बीच आकर्षण तथा प्रतिकर्षण बल उत्पन्न होते हैं। आकर्षण बल निम्नलिखित स्पीशीज के मध्य उत्पन्न होते हैं –
- एक परमाणु के नाभिक तथा उसके इलेक्ट्रॉनों के बीच NA – eA, NB – eB
- एक परमाणु के नाभिक तथा दूसरे परमाणु के इलेक्ट्रॉनों के बीच NA – eB, NB – eA
इसी प्रकार निम्नलिखित स्पीशीज के मध्य प्रतिकर्षण बल उत्पन्न होते हैं –
- दोनों परमाणुओं के इलेक्ट्रॉनों के बीच eA – eB तथा
- दोनों परमाणुओं के नाभिकों के बीच NA – NB
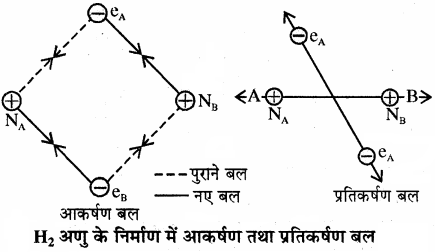
आकर्षण बल के कारण दोनों परमाणु पास आते हैं जबकि प्रतिकर्षण बल के कारण ये दूर होते हैं। प्रयोगों से यह पाया गया कि नए आकर्षण बलों का मान नए प्रतिकर्षण बलों के मान की तुलना में अधिक होता है। इसके कारण दोनों परमाणु एक – दूसरे के पास आते हैं। इससे उनकी स्थितिज ऊर्जा में कमी होती है तथा अन्त में एक ऐसी स्थिति आती है, जहाँ पर नेट आकर्षण बल तथा प्रतिकर्षण बल बराबर हो जाता है और निकाय की ऊर्जा न्यूनतम हो जाती है तथा दोनों हाइड्रोजन परमाणुओं के मध्य बन्ध बन जाता है। हाइड्रोजन के दो परमाणुओं के मध्य आबन्ध बनने पर ऊर्जा मुक्त होती है। इसी कारण हाइड्रोजन के अणु का स्थायित्व दो पृथक् परमाणुओं की अपेक्षा अधिक होता है।
दो परमाणुओं के मध्य आबन्ध बनने पर मुक्त ऊर्जा को आबंध एन्थैल्पी या आबंध ऊर्जा कहते हैं जो कि नीचे दिए गए चित्र में न्यूनतम के संगत है। इसके विपरीत हाइड्रोजन के एक मोल अणुओं के वियोजन के लिए 435.8 kJ ऊर्जा की आवश्यकता होती है तथा दो नाभिकों के बीच की न्यूनतम दूरी जो न्यूनतम ऊर्जा तथा अधिकतम स्थायित्व के संगत है, उसे आबंध लम्बाई कहते हैं।
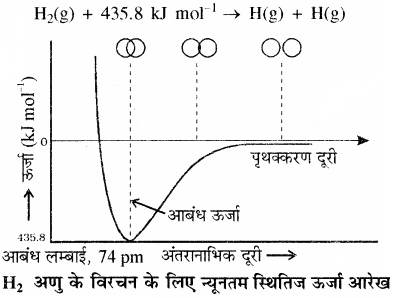
न्यूनतम स्थितिज ऊर्जा आरेख जब दो परमाणु एक – दूसरे के समीप आते हैं तथा उनकी स्थितिज ऊर्जा में वृद्धि होती है तब कोई रासायनिक आबंध नहीं बनता है।
उदाहरण:
जब दो हीलियम परमाणु आबन्धन हेतु एक – दूसरे के समीप आते हैं तो प्रतिकर्षण बल, आकर्षण बल की अपेक्षा अधिक होते हैं। जिसके फलस्वरूप निकाय की ऊर्जा में वृद्धि होती है और निकाय अस्थायी हो जाता है। अतः हीलियम अणु (He2) का बनना असम्भव होता है।
प्रश्न 37.
PCl5 अणु में संकरण का वर्णन कीजिए। इसमें अक्षीय आबंध विषुवतीय आबंधों की अपेक्षा अधिक लम्बे तथा दुर्बल क्यों होते हैं?
उत्तर:
PCl5:
फॉस्फोरस (P) का इलेक्ट्रॉनिक विन्यास निम्न प्रकार होता है। फॉस्फोरस में बन्ध बनते समय 3s कक्षक से एक इलेक्ट्रॉन उत्तेजित होकर रिक्त 3dz2 कक्षक में चला जाता है अतः इस अवस्था में फॉस्फोरस में पाँच अयुग्मित इलेक्ट्रॉन हो जाते हैं।
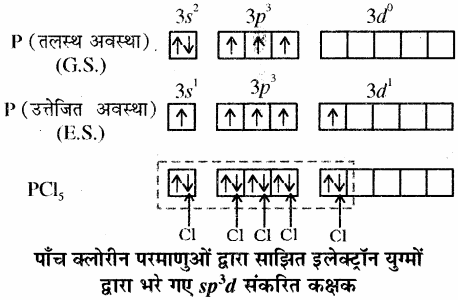
इस प्रकार पाँच कक्षक (एक s, तीन p तथा एक d कक्षक) संकरण के लिए उपलब्ध हो जाते हैं जो आपस में मिलकर पाँच sp3d संकर कक्षक बनाते हैं, जो त्रिकोणीय द्वि – पिरामिड के पाँच कोनों की ओर स्थित होते हैं।
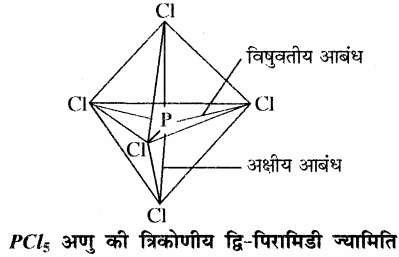
इस त्रिकोणीय द्विपिरामिडी ज्यामिति में सभी आबंध कोण समान नहीं होते हैं। PCl5 में फॉस्फोरस के पाँच sp3d संकर कक्षक क्लोरीन परमाणुओं के अर्ध – भरे कक्षकों से अतिव्यापन करके पाँच P – Cl सिग्मा – आबंध बना लेते हैं। इनमें से तीन P – Cl आबंध एक ही तल में होते हैं जो परस्पर 120° का कोण बनाते हैं। इन्हें ‘विषुवतीय आबंध’ कहते हैं। अन्य दो P – Cl आबंध क्रमशः विषुवतीय तल के ऊपर तथा नीचे होते हैं तथा तल से 90° का कोण बनाते हैं। इन्हें अक्षीय आबंध कहते हैं। अक्षीय आबंध कक्षक तथा विषुवतीय आबंध कक्षकों के बीच की दूरी कम होने के कारण प्रतिकर्षण अधिक होता है जिससे अक्षीय आबन्ध लम्बाई बढ़ जाती है तथा ये तुलनात्मक रूप से कम प्रबल होते हैं इसी कारण PCl5 क्रियाशील होता है तथा गैसीय अवस्था में वियोजित होकर PCl3 व Cl2 देता है – PCl5 → PCl3 + Cl2.
लेकिन नवीनतम NMR अध्ययनों से ज्ञात हुआ है कि PCl5 में सभी P – Cl आबन्ध की लम्बाई समान होती है।
प्रश्न 38.
परमाणु कक्षकों के संकरण से आप क्या समझते हैं? sp, sp2 तथा sp3 संकरण को उदाहरण सहित समझाइए।
उत्तर:
संकरण के प्रकार:
s तथा p कक्षकों के संयोग से होने वाले संकरण निम्न प्रकार के होते हैं –
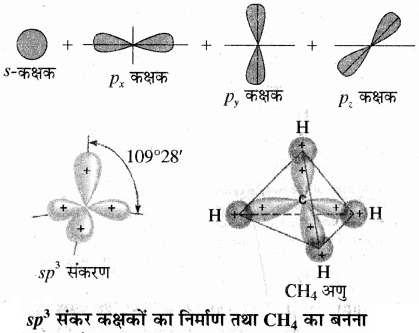
(i) चतुष्फलकीय अथवा sp3 संकरण:
sp3 संकरण को चतुष्फलकीय संकरण भी कहा जाता है। इसमें एक s तथा तीन p कक्षक आपस में मिलकर चार नए sp3 संकरित कक्षक बनाते हैं। प्रत्येक sp3 कक्षक में 25% s लक्षण तथा 75% p लक्षण होते हैं।
उदाहरण:
1. CH4 (मेथेन):
मेथेन में कार्बन की उत्तेजित अवस्था (6C = 1s2 2s1 2px1 2py1 2pz1) में सहसंयोजी कक्ष के एक s कक्षक तथा तीन p कक्षकों के संकरण से चार sp3 संकर कक्षक बनते हैं। ये संकर कक्षक समान ऊर्जा तथा आकृति के होते हैं। sp3 संकरण द्वारा प्राप्त चार sp3 संकर कक्षक चतुष्फलक के चार कोनों की ओर स्थित होते हैं तथा इनके बीच कोण का मान 109°28′ होता है। कार्बन के ये चारों sp3 संकरित कक्षक 4 हाइड्रोजन परमाणुओं के s कक्षकों के साथ पृथक् – पृथक् अतिव्यापन करके चार σ बन्ध बनाते हैं।
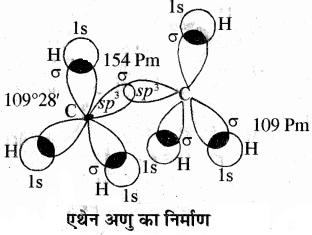
2. C2H6 (एथेन):
एथेन में दोनों कार्बन परमाणु sp3 संकरित अवस्था में होते हैं। अतः प्रत्येक कार्बन के पास चार sp3 संकरित कक्षक होते हैं। कार्बन परमाणु के चार sp3 संकरित कक्षकों में से एक sp3 संकरित कक्षक अन्य कार्बन परमाणु के एक sp3 संकर कक्षक से अक्षीय अतिव्यापन करके सिग्मा आबंध बनाता है, जबकि प्रत्येक कार्बन परमाणु के अन्य तीन sp3 संकर कक्षक तीन हाइड्रोजन परमाणुओं के 1s कक्षकों के साथ पृथक् – पृथक् अतिव्यापन (sp3 – s) करके सिग्मा आबंध बनाते हैं। इसमें C – C आबंध लम्बाई 154 Pm तथा C – H आबंध लम्बाई 109Pm होती है। HCH आबंध कोण 109°28′ होता है।
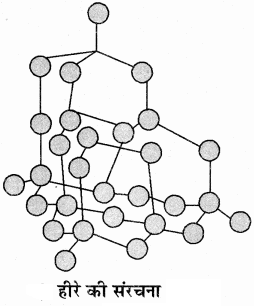
3. हीरा:
हीरे में प्रत्येक कार्बन परमाणु sp3 संकरित अवस्था में होता है। अतः प्रत्येक कार्बन पर चार sp3 संकरित कक्षक होते हैं जो अपने निकटतम कार्बन परमाणु के sp3 संकरित कक्षकों के साथ अतिव्यापन करके σ बन्ध बनाते हैं। इस प्रकार प्रत्येक कार्बन परमाणु चार अन्य कार्बन परमाणुओं से चतुष्फलकीय रूप से जुड़कर एक दीर्घ जटिल त्रिविम संरचना का निर्माण करते हैं। जिसके कारण हीरा कठोरतम पदार्थ होता है तथा इसका गलनांक उच्च (लगभग 3500°C) होता है। हीरे में मुक्त इलेक्ट्रॉन नहीं होने के कारण यह विद्युत का कुचालक होता है।
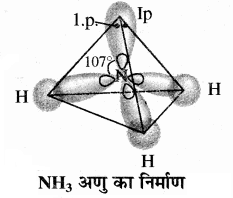
4. NH3:
NH3 में नाइट्रोजन परमाणु का तलस्थ (मूल) अवस्था इलेक्ट्रॉनिक विन्यास 1s2 2s2 2px1 2py1 2pz1 होता है। इसके एक s तथा तीन p – कक्षक मिलकर चार sp3 संकर कक्षक बना लेते हैं। इन sp3 संकर कक्षकों में तीन sp3 संकर कक्षकों में अयुग्मित इलेक्ट्रॉन होता है, जबकि चौथे sp3 संकर कक्षक में एक एकाकी इलेक्ट्रॉन युग्म होता है। नाइट्रोजन के तीन sp3 संकर कक्षक तीन हाइड्रोजन परमाणुओं के 1s कक्षकों के साथ अतिव्यापन द्वारा तीन N – H आबन्ध का निर्माण करते हैं। एकाकी इलेक्ट्रॉन युग्म तथा आबंधी इलेक्ट्रॉन युग्म के बीच प्रतिकर्षण दो आबन्धी इलेक्ट्रॉन युग्म की अपेक्षा अधिक होता है। इसके कारण NH3 में आबंध कोण 109.5° से घटकर 107° हो जाता है तथा ज्यामिति विकृत होकर त्रिकोणीय पिरामिडी हो जाती है। एकाकी इलेक्ट्रॉन युग्म के कारण ही NH3 का द्विध्रुव आघूर्ण उच्च होता है।
5. H2\(\ddot { O } { : }\) –
H2O में ऑक्सीजन का तलस्थ (मूल) अवस्था (Ground State) में बाह्यतम इलेक्ट्रॉनिक विन्यास निम्न प्रकार होता है –
8O = 2s2 2px2, 2py1 2pz1
इसमें एक s तथा तीन p कक्षक आपस में मिलकर चार sp3 संकर कक्षक बना लेते हैं। इनमें से दो संकर कक्षकों में एक – एक इलेक्ट्रॉन होता है तथा शेष दो संकर कक्षकों में एकाकी इलेक्ट्रॉन युग्म उपस्थित होते हैं। ये चार sp3 संकर कक्षक चतुष्फलकीय ज्यामिति ग्रहण करते हैं, जिसमें दो कोनों पर हाइड्रोजन परमाणु आबंधित होते हैं तथा अन्य दो कोनों पर एकाकी इलेक्ट्रॉन युग्म उपस्थित होते हैं। l.p – l.p प्रतिकर्षण के कारण इसमें आबंध कोण 109.5° से घटकर 104.5° हो जाता है तथा अणु की आकृति कोणीय या झुकी हुई या V – जैसी होती है।
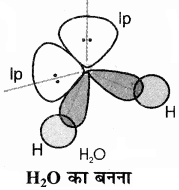
यहाँ यह समझने योग्य है कि CH4, NH3, तथा H2O) तीनों में केन्द्रीय परमाणु sp3 संकरित अवस्था में हैं लेकिन इनमें इलेक्ट्रॉन युग्मों में भिन्नता के कारण इनकी ज्यामिति तथा बन्ध कोण भिन्न – भिन्न होते हैं। CH4 में चारों बन्धित इलेक्ट्रॉन युग्म है, अतः इसकी आकृति सममित चतुष्फलकीय है तथा बन्ध कोण 109°28′ है। NH3 में एक 1.p तथा 3 b.p हैं अतः इसकी आकृति त्रिकोणीय पिरैमिडी तथा बन्ध कोण 107° (1.p – b.p प्रतिकर्षण के कारण) होता है लेकिन H2O में दो 1.p तथा दो b.p हैं अतः इसकी आकृति कोणीय या V जैसी होती है। तथा बन्ध कोण का मान और भी कम होकर 104°28′ रह जाता है। (1.p – b.p प्रतिकर्षण के कारण).
sp3 संकरण के अन्य उदाहरण निम्न हैं – CCl4, SiCl4, \(\overset { + }{ N } \)H4, \(\overset { – }{ B } \)F4, SO42-, NF3, PCl3, Cl2O, OF2 तथा [Ni(CO)4]
(ii) त्रिकोणीय समतलीय अथवा sp2 संकरण:
sp2 संकरण को त्रिकोणीय संकरण भी कहते हैं। इस संकरण में एक s कक्षक तथा दो p कक्षक संकरित होकर तीन समान sp2 संकर कक्षक बनाते हैं। sp2 संकरित कक्षकों में 33% s लक्षण तथा 66% p – लक्षण होते हैं।
उदाहरण:
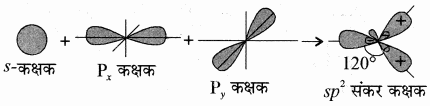
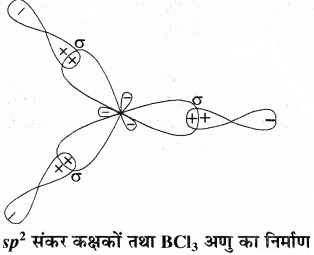
1. BCl3 या BF3:
BCl3 में केंद्रीय बोरॉन परमाणु का मूल अवस्था विन्यास 1s2 2s2 2p1 होता है। उत्तेजित अवस्था में एक 2s इलेक्ट्रॉन रिक्त 2p कक्षक में चला जाता है, (5B = 1s2 2s1 2px1 2py1) जिससे बोरॉन में तीन अयुग्मित इलेक्ट्रॉन हो जाते हैं। ये तीन (एक 2s तथा दो 2p) कक्षक संकरित होकर तीन sp2 संकर कक्षक बनाते हैं। ये तीन संकर कक्षक त्रिकोणीय समतल ज्यामिति में व्यवस्थित होते हैं। ये तीन sp2 संकरित कक्षक क्लोरीन के अयुग्मित इलेक्ट्रॉन युक्त 2p कक्षकों के साथ अतिव्यापन करके तीन B – Cl σ आबन्धों का निर्माण करते हैं। इसलिए BCl3 अणु की ज्यामिति त्रिकोणीय समतली होती है। जिसमें Cl – B – Cl आबंध कोण का मान 120° होता है।
2.
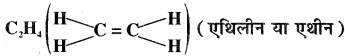
एथीन में कार्बन की उत्तेजित अवस्था में एक s कक्षक तथा दो p कक्षकों के संकरण से तीन sp2 संकरित कक्षक बनते हैं तथा प्रत्येक कार्बन पर एक असंकरित p कक्षक बच जाता है। एथीन के बनने में एक कार्बन परमाणु का sp2 संकर कक्षक दूसरे कार्बन के sp2 संकर कक्षक से अक्षीय अतिव्यापन करके C – C सिग्मा आबंध बनाता है, जबकि प्रत्येक कार्बन परमाणु के शेष दो sp2 संकर कक्षक हाइड्रोजन परमाणुओं के s कक्षकों के साथ अतिव्यापन कर sp2 – s सिग्मा आबंध बनाते हैं तथा एक कार्बन का असंकरित कक्षक (2px अथवा 2py) दूसरे कार्बन के समान कक्षक के साथ सम्पाश्विक अतिव्यापन करके π आबंध बनाता है जिसमें कार्बन तथा हाइड्रोजन परमाणुओं के तल के ऊपर तथा नीचे दो समान इलेक्ट्रॉन अभ्र उपस्थित होते हैं। π बन्ध बनाने वाले असंकरित p – कक्षक अणु की अक्ष के लम्बवत् होते हैं। एथीन में H – C – H तथा H – C – C बन्ध कोण का मान क्रमशः 117.6° तथा 121° होता है तथा C = C बन्ध लम्बाई 134Pm एवं C – H बन्ध लम्बाई 109Pm होती है। एथीन अणु में सिग्मा तथा पाई आबंधों का बनना नीचे दिए गए चित्र में प्रदर्शित किया गया है –
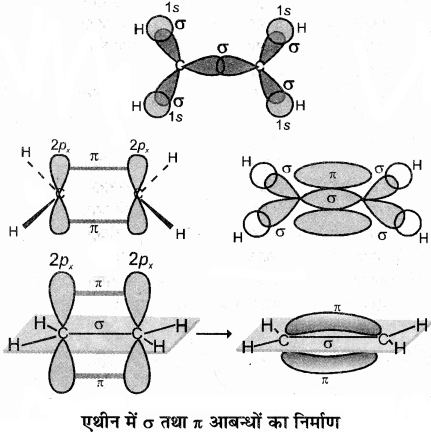
3. ग्रेफाइट:
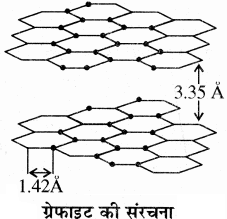
ग्रेफाइट में प्रत्येक कार्बन परमाणु तीन कार्बन परमाणुओं के साथ सहसंयोजी बन्ध से जुड़ा होता है। इसमें प्रत्येक कार्बन sp2 संकरित अवस्था में होता है तथा C – C – C आबंध कोण 120° का होता है। अतः सभी कार्बन परमाणु आपस में एक ही तल में जुड़कर षट्कोणीय वलय का निर्माण करते हैं। ये षट्कोणीय वलय आपस में जुड़कर एक परत बनाती हैं। sp2 संकरण के बाद प्रत्येक कार्बन परमाणु पर एक असंकरित p – कक्षक बच जाता है। एक परत के ये p – कक्षक दूसरी परत के p – कक्षकों के साथ अतिव्यापन करके दुर्बल बन्ध बनाते हैं। जिनकी बन्ध लम्बाई अधिक (3.35Å) होती है। लेकिन एक ही परत में C – C बन्ध लम्बाई कम (1.42Å) होती है। चूंकि एक परत के सभी कार्बन दूसरी परत के सभी कार्बन परमाणुओं से बन्ध नहीं बनाते हैं। अतः इन शेष बचे कार्बन परमाणुओं के p – इलेक्ट्रॉन स्वतंत्र रहते हैं, जिनके द्वारा विद्युत धारा का प्रवाह आसानी से हो जाता है। इसी कारण ग्रेफाइट विद्युत का सुचालक होता है। ग्रेफाइट की दो परतों के मध्य दुर्बल बन्ध होने के कारण थोड़ा – सा बल लगाने पर ही ये आसानी से टूट जाते हैं। तथा एक परत दूसरी परत पर खिसक जाती है। इसी कारण ग्रेफाइट मुलायम होता है।
sp2 संकरण के अन्य उदाहरण निम्न हैं – SO3, SnCl2, SO2, \(\overset { + }{ C } \)H3, CO32-, \(\overset { – }{ N } \)O2 तथा \(\overset { – }{ N } \)O3.
(iii) रेखीय या विकर्ण या sp संकरण:
sp संकरण को रेखीय या विकर्णी संकरण भी कहते हैं। इस प्रकार के संकरण में एक s तथा एक p कक्षक आपस में मिलकर दो समान sp संकर कक्षक बनाते हैं। sp संकरण के लिए s तथा pz, कक्षक उपयुक्त होते हैं। प्रत्येक sp संकर कक्षक में 50% s – लक्षण तथा 50% p – लक्षण होता है। इसमें अणु की ज्यामिति रेखीय होती है। sp संकर कक्षकों के दो उभरे हुए धन लोब (पालि) तथा अत्यंत छोटे ऋण लोब विपरीत दिशाओं में Z – अक्ष की ओर दृष्ट (point) होते हैं। इसके कारण प्रभावी अतिव्यापन होता है, जिसके कारण प्रबल आबंध बनते हैं।
उदाहरण:
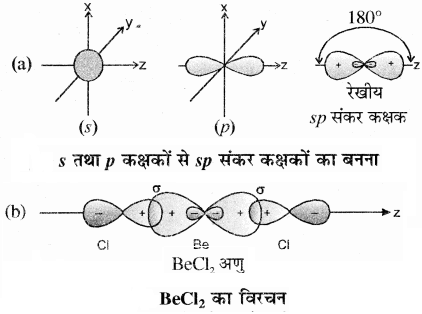
1. BeCl2:
मूल अवस्था (Ground State) में Be का इलेक्ट्रॉनिक विन्यास 1s2 2s2 होता है। उत्तेजित अवस्था में एक 2s इलेक्ट्रॉन रिक्त 2p कक्षक में चला जाता है। एक 2s कक्षक तथा एक 2p कक्षक संकरित होकर दो sp संकर कक्षक बनाते हैं तथा ये आपस में 180° का कोण बनाते हैं। प्रत्येक sp संकर कक्षक क्लोरीन के 2p कक्षक से अक्षीय अतिव्यापन करके दो Be – Cl सिग्मा आबंध बनाते हैं।
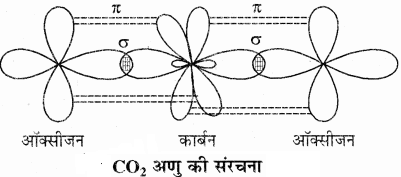
2. CO2:
CO2 में कार्बन की उत्तेजित अवस्था (6C = 1s2 2s1 2px1 2py1 2pz1) में 2s व एक 2p कक्षक संकरित होकर दो sp संकर कक्षक बनाते हैं। ये दो sp संकरित कक्षक दो ऑक्सीजन परमाणुओं के अयुग्मित इलेक्ट्रॉन युक्त 2py कक्षकों से पृथक् – पृथक् अतिव्यापन करके दो σ आबन्ध बनाते हैं। कार्बन परमाणु पर शेष बचे दो असंकरित कक्षक जिनमें अयुग्मित इलेक्ट्रॉन उपस्थित हैं दोनों ऑक्सीजन परमाणुओं के अयुग्मित इलेक्ट्रॉन वाले 2pz कक्षकों से पृथक् – पृथक् सम्पाश्र्विक अतिव्यापन करके दो π आबन्ध बनाते हैं। लेकिन CO2 की ज्यामिति भी रेखीय होती है तथा बन्ध कोण का मान 180° होता है।
3. C2H2(HC ≡ CH) (ऐसिटिलीन या एथाइन):
एथाइन में दोनों कार्बन sp संकरित अवस्था में होते हैं। इसमें प्रत्येक कार्बन की उत्तेजित अवस्था में (6C = 1s2 2s1 2px1 2py1 2pz1) एक s तथा एक p कक्षक आपस में मिलकर दो sp संकरित कक्षक बनाते हैं। तथा दोनों कार्बन परमाणु पर दो – दो असंकरित कक्षक (2py तथा 2px) उपस्थित रहते हैं। एक कार्बन परमाणु का sp संकर कक्षक दूसरे कार्बन परमाणु के sp संकर कक्षक से अक्षीय अतिव्यापन करके C – C सिग्मा आबंध बनाता है। शेष sp संकर कक्षक हाइड्रोजन के 1s कक्षकों के साथ अतिव्यापन करके सिग्मा आबंध बनाते हैं। दोनों कार्बन परमाणुओं पर उपस्थित दो – दो असंकरित कक्षक सम्पाश्विक अतिव्यापून द्वारा दो पाई – आबंध बनाते हैं। इस प्रकार एथाइन में दो कार्बन परमाणुओं के बीच त्रि-आबंध होता है (बन्ध लम्बाई 120Pm) जिसमें एक सिग्मा तथा दो पाई आबंध होते हैं। C2H2 में भी प्रत्येक कार्बन रेखीय ज्यामिति दर्शाता है तथा बन्ध कोण 180° होता है। जिनका चित्रण निम्न प्रकार है –
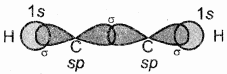
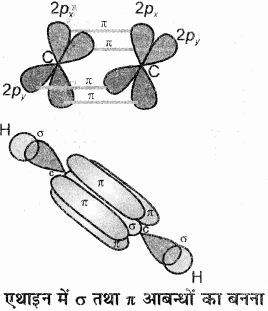
एथाइन में सिग्मा (σ) बन्ध के चारों ओर दोनों अक्षों पर दो पाई बन्ध के इलेक्ट्रॉन अभ्र बेलनाकार आकृति के रूप में पाये जाते हैं।
sp संकरण के अन्य उदाहरण निम्न हैं – CO, HgCl2, CdCl2, [Ag(CN)2]
प्रश्न 39.
अणु कक्षक सिद्धान्त क्या है? समनाभिकीय द्विपरमाणुक अणुओं के आणविक कक्षकों का ऊर्जा स्तर समझाते हुए निम्नलिखित श्रेणी के बढ़ते हुए स्थायित्व को समझाइएं।
O22-< O2–< O2 < O2–
उत्तर:
अणु कक्षक सिद्धान्त:
संयोजकता बन्ध सिद्धान्त की कमियों को दूर करने के लिए हुंड तथा मुलिकन द्वारा 1932 में आण्विक कक्षक सिद्धान्त दिया गया जो कि परमाणु कक्षकों के अतिव्यापन पर आधारित है। आण्विक कक्षक सिद्धान्त के अनुसार परमाणु कक्षकों के अतिव्यापन से आण्विक कक्षकों का निर्माण होता है तथा परमाणु कक्षक अपनी पहचान खो देते हैं जबकि संयोजकता बन्ध सिद्धान्त में बन्ध बनने के पश्चात् भी परमाणु अपनी पहचान बनाए रखते हैं।
आण्विक कक्षक सिद्धान्त के मुख्य बिन्दु निम्नलिखित हैं –
- जिस प्रकार परमाणु में इलेक्ट्रॉन विभिन्न परमाणु कक्षकों में उपस्थित रहते हैं, उसी प्रकार अणु में इलेक्ट्रॉन विभिन्न आण्विक कक्षकों में उपस्थित रहते हैं।
- आण्विक कक्षक समान ऊर्जाओं एवं उपयुक्त सममिति वाले परमाणु कक्षकों के संयोग से बनते हैं।
- परमाणु कक्षक के इलेक्ट्रॉन एक ही नाभिक के प्रभाव में रहते हैं, जबकि आण्विक कक्षक के इलेक्ट्रॉन दो या दो से अधिक नाभिकों द्वारा प्रभावित होते हैं। अतः परमाणु कक्षक एककेंद्रीय होते हैं, जबकि आण्विक कक्षक बहुकेंद्रीय होते हैं।
- बनने वाले आण्विक कक्षकों की संख्या संयोग करने वाले परमाणु कक्षकों की संख्या के बराबर होती है। आण्विक कक्षक दो प्रकार के होते हैं – ‘आबंधन आण्विक कक्षक’ या ‘बन्धी आण्विक कक्षक’ तथा ‘प्रतिआबंधन आण्विक कक्षक’ या ‘विपरीत बन्धी आण्विक कक्षक’।
- बन्धी आण्विक कक्षकों की ऊर्जा विपरीत बन्धी आण्विक कक्षकों की ऊर्जा से कम होती है अतः बन्धी आण्विक कक्षकों का स्थायित्व संगत विपरीत बन्धी आण्विक कक्षकों से अधिक होता है।
- आण्विक कक्षकों की आकृति संयोग करने वाले परमाणु कक्षकों की आकृति पर निर्भर करती है।
- जिस प्रकार किसी परमाणु के नाभिक के चारों ओर इलेक्ट्रॉन प्रायिकता वितरण परमाणु कक्षक द्वारा दिया जाता है, उसी प्रकार किसी अणु में नाभिकों के समूह के चारों ओर इलेक्ट्रॉन प्रायिकता वितरण आण्विक कक्षक द्वारा दिया जाता है।
- परमाणु कक्षकों की भाँति आण्विक कक्षकों में भी पाउली के नियम तथा हुंड के नियम के अनुसार ऑफबाऊ सिद्धान्त का पालन करते हुए इलेक्ट्रॉन भरे जाते हैं।
आण्विक कक्षकों का ऊर्जा स्तर आरेख:
हम पढ़ चुके हैं कि दो परमाणुओं में उपस्थित 1s परमाणु कक्षकों के संयोग से दो आण्विक कक्षक बनते हैं जिन्हें σ1s तथा σ* 1s कहते हैं। इसी प्रकार दो परमाणुओं के 2s तथा 2p कक्षकों (8 कक्षक) के रैखिक संयोग से निम्नलिखित आठ आण्विक कक्षकों का निर्माण होता है –
बन्धी आण्विक कक्षक: σ2s, σ2pz, π2px, π2py
विपरीत बन्धी आण्विक कक्षक σ* 2s, σ* 2pz, π*2px, π*2py
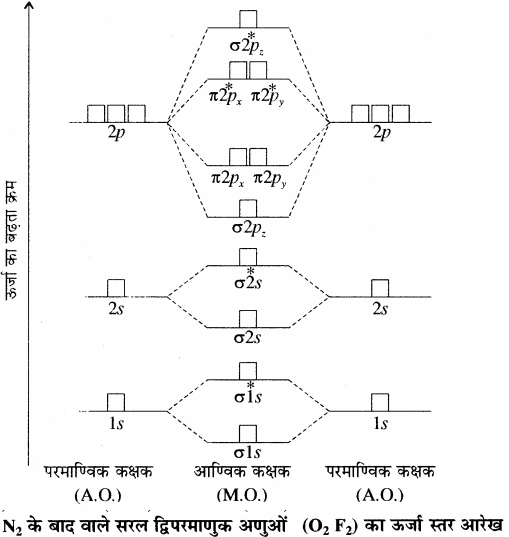
आण्विक कक्षकों की ऊर्जा का क़म-आण्विक कक्षकों की ऊर्जा का क्रम प्रयोग द्वारा स्पेक्ट्रमी विधियों द्वारा ज्ञात किया जाता है। द्वितीय आवर्त के तत्त्वों के समनाभिकीय द्विपरमाणुक अणुओं जैसे O2, F2 के आण्विक कक्षकों की ऊर्जा का बढ़ता क्रम निम्न प्रकार होता है –
σ1s < σ*1s < σ2s < σ*2s < σ2pz < (π2px = π2py) < (π*2px = π*2py) < σ*2pz
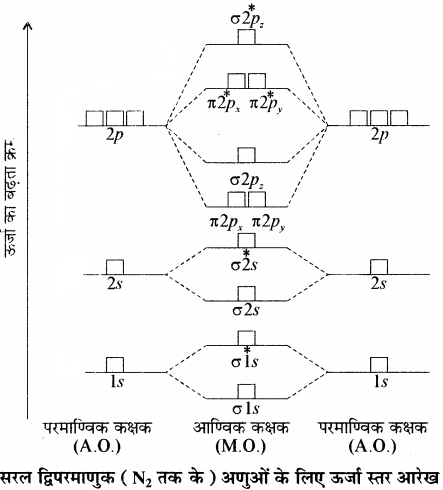
द्वितीय आवर्त के शेष बचे अणुओं जैसे (Li2, Be2, B2, C2, तथा N2) के लिए उपरोक्त क्रम में थोड़ा परिवर्तन होता है तथा σ2pz की ऊर्जा π2px तथा π2py से अधिक होती है अतः इनका निम्न प्रकार है –
σ1s < σ*1s < σ2s < σ*2s < (π2px = π2py) < σ2pz < (π*2px = π*2py) < σ*2pz
यहाँ यह बात ध्यान देने योग्य है कि π2px तथा π2py की ऊर्जा समान होती है अतः इन्हें समभ्रंश कक्षक कहते हैं। इसी प्रकार π*2px तथा *π*2py की ऊर्जा भी समान होती है अतः ये भी समभ्रंश कक्षक होते हैं।
Li2 से N2 तक के आण्विक कक्षकों में π2px तथा π2py कक्षकों की ऊर्जा σ2pz कक्षक से कम होती है। इसका सम्भावित कारण यह है कि इनमें σ2s, व σ2pz कक्षकों की ऊर्जा में इतना कम अन्तर होता है कि वे एक – दूसरे के साथ मिश्रित से होकर संकरित होने लगते हैं जिससे σ2s शुद्ध σ2s कक्षक नहीं रहता जबकि σ2p कक्षक विशुद्ध σ2pz कक्षक नहीं रह पाता। इससे oकक्षकों की ऊर्जा तो अपेक्षा से कम हो जाती है जबकि σ2pz कक्षक की ऊर्जा अपेक्षा से कुछ अधिक हो जाती है। ऐसा होने पर σ2pz कक्षक की ऊर्जा का π2px व π2py कक्षकों की ऊर्जा की तुलना में कुछ अधिक हो जाती है। अतः आवर्त के प्रारम्भिक (N2 तक के) तत्त्वों का ऊर्जा स्तर आरेख अग्र प्रकार होता है –
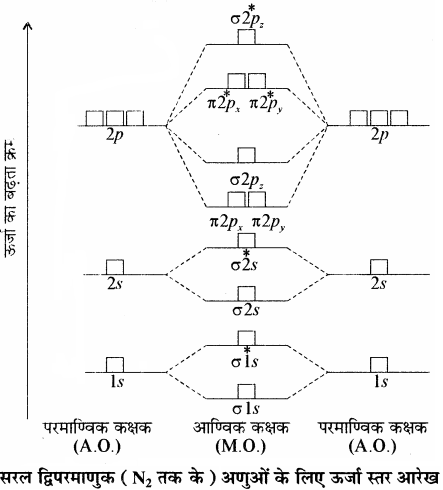
N2 के बाद वाले सरल द्विपरमाणुक अणुओं (O2, F2) का ऊर्जा स्तर आरेख निम्न प्रकार होता है –
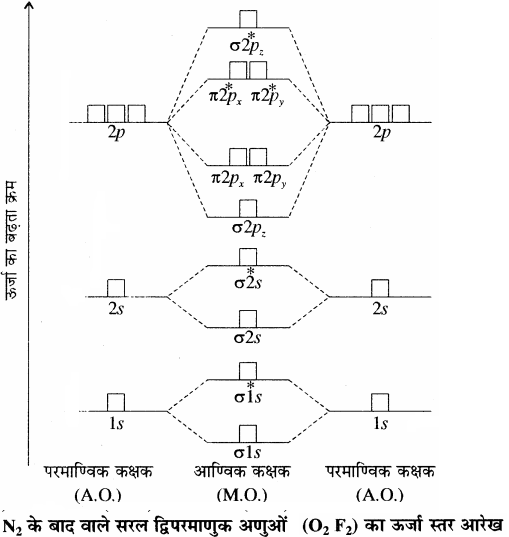
O2 – अणु:
ऑक्सीजन परमाणु का इलेक्ट्रॉनिक विन्यास 1s2 2s2 2p4 होता है। प्रत्येक ऑक्सीजन परमाणु में 8 इलेक्ट्रॉन होते हैं अतः ऑक्सीजन अणु में कुल 16 इलेक्ट्रॉन होंगे।
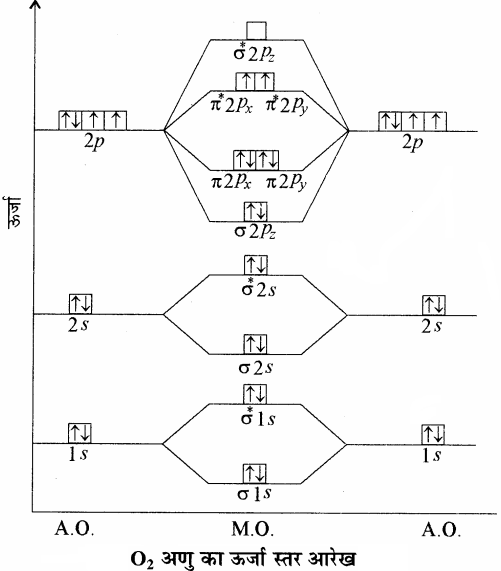
उपरोक्त ऊर्जा स्तर आरेख के आधार पर O2 का इलेक्ट्रॉनिक विन्यास निम्न प्रकार होगा –
O2 = (σ1s)2 (σ*1s)2 (σ2s)2 (σ*2s)2 (σ2pz)2 (π2px2 =π2py2) (π*2px 1= π*2py 1)
अथवा O2 = KK (σ2s)2 (σ*2s)2 (σ2pz)2 (π2px2 =π2py2) (π*2px1= π*2py1)
तथा आबन्ध कोटि = \(\frac { 1 }{ 2 } \)(Nb – Na)
= \(\frac { 1 }{ 2 } \)(10 – 6) = 2
अतः O2 अणु में ऑक्सीजन परमाणु एक द्वि – आबंध द्वारा जुड़े होते है। (\({ O }\frac { \sigma }{ \pi } { O }\))। ऑक्सीजन अणु के π*2px तथा π*2py आण्विक कक्षकों में एक – एक अयुग्मित इलेक्ट्रॉन उपस्थित है, इसलिए ऑक्सीजन अणु को अनुचुम्बकीय होना चाहिए तथा प्रायोगिक तौर पर भी ऐसा पाया गया है। इस प्रकार आण्विक कक्षक सिद्धान्त से ऑक्सीजन के अनुचुम्बकीय व्यवहार की व्याख्या की जा सकती है। जिसे संयोजकता बन्ध सिद्धान्त के आधार पर नहीं समझाया जा सका था।
O2 के आयन:
1. O2+आयन:
यदि O2 अणु में से एक इलेक्ट्रॉन कम कर दिया जाए तो O2+ आयन बनेगा, स्वाभाविक है कि वह इलेक्ट्रॉन उसके π – विपरीत बन्धी कक्षक में से निकलेगा और तब उसका विन्यास निम्न प्रकार हो जाएगा – KK (σ2s)2 (σ*2s)2 (σ2pz)2 (π2px)2 (π2py)2 (π*2px)1
अतः बन्ध क्रम = \(\frac { 10-{ 5 } }{ 2 } \) = 2.5
इसका बन्ध क्रम O2 अणु से अधिक है अतः इसकी बन्ध लम्बाई का मान O2 से कम हो जाता है। इसके अतिरिक्त O2 अणु में विपरीत बन्धी कक्षकों में दो अयुग्मित इलेक्ट्रॉन हैं जबकि O2+ में केवल एक अयुग्मित इलेक्ट्रॉन है जो कि O2 के अस्थायित्व को प्रदर्शित करता है। अतः O2+ आयन O2 अणु से अधिक स्थायी होता है तथा यह भी अनुचुम्बकीय है।
2. O2– आयन:
O2– आयन से तात्पर्य है कि O2 अणु में एक इलेक्ट्रॉन और जुड़ जाए, स्वाभाविक है कि यह इलेक्ट्रॉन भी विपरीत बन्धी, कक्षक में ही जाएगा अतः इसका विन्यास निम्न प्रकार होगा –
KK (σ2s)2 (σ*2s)2 (σ2pz)2 (π2px)2 (π2py)2 (π*2px)2(π*2py)1
अतः O2 आयन का बन्ध क्रम = \(\frac { 10-{ 7 } }{ 2 } \) = 1.5
अर्थात् इसका बन्ध क्रम O2 अणु से कम है अतः इसकी बन्ध दूरी का मान O2 से अधिक हो जाता है। इसके अतिरिक्त विपरीत बन्धी कक्षकों में इलेक्ट्रॉनों की संख्या में भी वृद्धि हो गयी अतः O2 का स्थायित्व O2 से कम हो जाता है तथा यह भी अनुचुम्बकीय ही है।
3. O22- आयन:
O2- आयन में एक ओर इलेक्ट्रॉन जोड़ दिया जाए तो O22-आयन बनता है तथा इसका बन्ध क्रम एक ही रह जाएगा और विपरीत बन्धी कक्षकों में इलेक्ट्रॉनों की संख्या बढ़ जाने से O22-का स्थायित्व और भी कम हो जाएगा, इसका इलेक्ट्रॉनिक विन्यास निम्न प्रकार होता है –
KK (σ2s)2 (σ*2s)2 (σ2pz)2(σ2px)2(π2py)2 (π*2px)2(π*2py)2
अतः बन्ध क्रम = \(\frac { 10-{ 8 } }{ 2 } \) = 1
O22-में सभी इलेक्ट्रॉन युग्मित होने के कारण यह प्रतिचुम्बकीय होता है।
अतः O2 तथा इसके विभिन्न आयनों की तुलना निम्न प्रकार है –

प्रश्न 40.
आबंध कोटि से आप क्या समझते हैं? निम्नलिखित में आबंध कोटि का परिकलन कीजिए।
N2, C2, H2-, N2-
उत्तर:
आण्विक कक्षकों का ऊर्जा स्तर आरेख:
हम पढ़ चुके हैं कि दो परमाणुओं में उपस्थित 1s परमाणु कक्षकों के संयोग से दो आण्विक कक्षक बनते हैं जिन्हें σ1s तथा σ* 1s कहते हैं। इसी प्रकार दो परमाणुओं के 2s तथा 2p कक्षकों (8 कक्षक) के रैखिक संयोग से निम्नलिखित आठ आण्विक कक्षकों का निर्माण होता है –
बन्धी आण्विक कक्षक: σ2s, σ2pz, π2px, π2py
विपरीत बन्धी आण्विक कक्षक σ* 2s, σ* 2pz, π*2px, π*2py
आण्विक कक्षकों की ऊर्जा का क़म-आण्विक कक्षकों की ऊर्जा का क्रम प्रयोग द्वारा स्पेक्ट्रमी विधियों द्वारा ज्ञात किया जाता है। द्वितीय आवर्त के तत्त्वों के समनाभिकीय द्विपरमाणुक अणुओं जैसे O2, F2 के आण्विक कक्षकों की ऊर्जा का बढ़ता क्रम निम्न प्रकार होता है –
σ1s < σ*1s < σ2s < σ*2s < σ2pz < (π2px = π2py) < (π*2px = π*2py) < σ*2pz
द्वितीय आवर्त के शेष बचे अणुओं जैसे (Li2, Be2, B2, C2, तथा N2) के लिए उपरोक्त क्रम में थोड़ा परिवर्तन होता है तथा σ2pz की ऊर्जा π2px तथा π2py से अधिक होती है अतः इनका निम्न प्रकार है –
σ1s < σ*1s < σ2s < σ*2s < (π2px = π2py) < σ2pz < (π*2px = π*2py) < σ*2pz
यहाँ यह बात ध्यान देने योग्य है कि π2px तथा π2py की ऊर्जा समान होती है अतः इन्हें समभ्रंश कक्षक कहते हैं। इसी प्रकार π*2px तथा *π*2py की ऊर्जा भी समान होती है अतः ये भी समभ्रंश कक्षक होते हैं।
Li2 से N2 तक के आण्विक कक्षकों में π2px तथा π2py कक्षकों की ऊर्जा σ2pz कक्षक से कम होती है। इसका सम्भावित कारण यह है कि इनमें σ2s, व σ2pz कक्षकों की ऊर्जा में इतना कम अन्तर होता है कि वे एक – दूसरे के साथ मिश्रित से होकर संकरित होने लगते हैं जिससे σ2s शुद्ध σ2s कक्षक नहीं रहता जबकि σ2p कक्षक विशुद्ध σ2pz कक्षक नहीं रह पाता। इससे oकक्षकों की ऊर्जा तो अपेक्षा से कम हो जाती है जबकि σ2pz कक्षक की ऊर्जा अपेक्षा से कुछ अधिक हो जाती है। ऐसा होने पर σ2pz कक्षक की ऊर्जा का π2px व π2py कक्षकों की ऊर्जा की तुलना में कुछ अधिक हो जाती है। अतः आवर्त के प्रारम्भिक (N2 तक के) तत्त्वों का ऊर्जा स्तर आरेख अग्र प्रकार होता है –
N2 के बाद वाले सरल द्विपरमाणुक अणुओं (O2, F2) का ऊर्जा स्तर आरेख निम्न प्रकार होता है –
इलेक्ट्रॉनिक विन्यास तथा आण्विक व्यवहार:
विभिन्न आण्विक कक्षकों में इलेक्ट्रॉनों के वितरण को इलेक्ट्रॉनिक विन्यास कहते हैं। इलेक्ट्रॉनों को आण्विक कक्षकों की ऊर्जा के बढ़ते क्रम में भरा जाता है। किसी अणु के इलेक्ट्रॉनिक विन्यास से उस अणु के बारे में बहुत – सी महत्त्वपूर्ण जानकारी प्राप्त हो जाती हैं जैसे अणु का स्थायित्व, आबंध कोटि, आबन्ध लम्बाई तथा चुम्बकीय प्रकृति –
- अणुओं का स्थायित्व:
यदि बन्धी आण्विक कक्षकों में उपस्थित इलेक्ट्रॉनों की संख्या Nb तथा विपरीत बन्धी आण्विक कक्षकों में इलेक्ट्रॉनों की संख्या Na हो, तो
अणु स्थायी होगा, यदि Nb > Na
क्योंकि बन्धी इलेक्ट्रॉनों की संख्या अधिक होने के कारण बंधी प्रभाव प्रबल होता है, अतः अणु स्थायी हो जाता है।
अणु अस्थायी होगा यदि Na > Nb
क्योंकि विपरीत बन्धी इलेक्ट्रॉनों की संख्या अधिक होने के कारण विपरीत बन्धी प्रभाव अधिक प्रबल होता है जिससे अणु अस्थायी हो जाता है। - आबंध कोटि या बन्ध क्रम:
बंधी आण्विक कक्षकों तथा विपरीत बन्धी आण्विक कक्षकों में उपस्थित इलेक्ट्रॉनों की संख्या के अन्तर के आधे को आबन्ध कोटि कहते हैं।
आबंध कोटि = \(\frac { 1 }{ 2 } \)(Nb – Na)
Nb = बन्धी आण्विक कक्षकों में इलेक्ट्रॉनों की संख्या
Na = विपरीत बन्धी आण्विक कक्षकों में इलेक्ट्रॉनों की संख्या
आबंध कोटि से किसी अणु में उपस्थित सहसंयोजी आबंधों की संख्या ज्ञात होती है यदि आबंध कोटि 1, 2 या 3 है तो उस अणु में क्रमशः एकल, द्वि या त्रि आबंध होंगे तथा आबंध कोटि का भान पूर्णाक या भिन्नात्मक हो सकता है।
यदि Nb > Na तो आबंध कोटि धनात्मक होगी तथा अणु स्थायी होगा तथा यदि Na > Nb तो आबंध कोटि ऋणात्मक होगी तथा यदि Nb = Na तो आबंध कोटि शून्य होगी।
आबन्ध कोटि का मान ऋणात्मक या शून्य होने पर अणु अस्थायी होगा। बन्थ क्रम का मान बढ़ने पर स्थायित्व बढ़ता है। - आबंध – लम्बाई:
सामान्यतः किसी अणु में दो परमाणुओं के बीच आबंध कोटि आबंध लम्बाई का एक सन्निकट माप होती है तथा आबंध लम्बाई आबंध कोटि के व्युत्क्रमानुपाती होती है। अर्थात् आबंध कोटि बढ़ने पर आबंध लम्बाई कम होती है।
आबंध कोटि ∝ आबन्ध सामर्थ्य ∝ आबन्ध ऊर्जा ∝ 1/ आबन्ध लम्बाई - चुम्बकीय प्रकृति:
जब किसी अणु के सभी आण्विक कक्षकों में इलेक्ट्रॉन युग्मित होते हैं तो वह अणु प्रतिचुम्बकीय (Diamagnetic) होता है तथा ऐसे अणु चुम्बकीय क्षेत्र में प्रतिकर्षित होते हैं, लेकिन यदि किसी अणु के एक या अधिक आण्विक कक्षकों में अयुग्मित इलेक्ट्रॉन उपस्थित होते हैं तो वह अणु अनुचुम्बकीय (Paramagnetic) होता है तथा ऐसे अणु चुम्बकीय क्षेत्र में आकर्षित होते हैं।
समनाभिकीय द्विपरमाणुक अणुओं में आबंधन:
इस भाग में हम कुछ समनाभिकीय द्विपरमाणुक अणुओं में आबंधन का अध्ययन करेंगे।
1. हाइड्रोजन अणु (H2):
H2 अणु, हाइड्रोजन के दो परमाणुओं के संयोजन से बनता है। प्रत्येक हाइड्रोजन के 1s कक्षक में एक इलेक्ट्रॉन होता है। अतः हाइड्रोजन अणु में कुल दो इलेक्ट्रॉन होंगे, जो σ1s आण्विक कक्षक में उपस्थित होते हैं। अतः हाइड्रोजन अणु का इलेक्ट्रॉनिक विन्यास निम्न प्रकार होगा –
H = (σ1s)2
आबंध कोटि = \(\frac { { N }_{ b }-{ N }_{ a } }{ 2 } \) = \(\frac { 2-{ 0 } }{ 2 } \) = 1
अर्थात् हाइड्रोजन अणु में हाइड्रोजन के दो परमाणु एक – दूसरे से एकल आबंध द्वारा बंधित होते हैं तथा हाइड्रोजन अणु की वियोजन ऊर्जा 438 kJ mol-1 है तथा H – H आबंध लम्बाई 74 pm होती है। चूंकि H2 में कोई अयुग्मित इलेक्ट्रॉन उपस्थित नहीं है अतः यह प्रतिचुम्बकीय होता है।
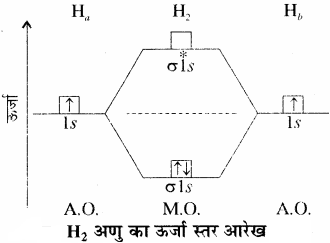
H2+आयन का इलेक्ट्रॉनिक विन्यास = (σ1s)1 होता है तथा इसमें बन्ध क्रम का मान, \(\frac { 1 }{ 2 } \)[0-1] = \(\frac { 1 }{ 2 } \) होगा। इसमें एक अयुग्मित इलेक्ट्रॉन उपस्थित होने के कारण यह अनुचुम्बकीय होता है।
H2– आयन का इलेक्ट्रॉनिक विन्यास (σ1s)2, (σ*1s)1 होता है तथा इसमें भी बन्ध क्रम होता है तथा यह भी अनुचुम्बकीय होता है।
H2, H2+ तथा H2– के स्थायित्व का क्रम निम्न प्रकार होता है –
H2 > H2+ > H2–
नोट –
H2+ तथा H2– दोनों में बन्ध क़म का मान \(\frac { 1 }{ 2 } \) है लेकिन H2– में विपरीत बन्धी आण्विक कक्षक में इलेक्ट्रॉन उपस्थित होने के कारण यह कम स्थायी होता है।
(2) हीलियम अणु:
हीलियम परमाणु का इलेक्ट्रॉनिक विन्यास 1s2 होता है। अर्थात् H2– अणु में कुल चार इलेक्ट्रॉन होंगे।
ये इलेक्ट्रॉन σ1s तथा σ*1s आण्विक कक्षकों में भरे जाएंगे अतः He2 का इलेक्ट्रॉनिक विन्यास निम्न प्रकार होगा –
He2 : (σ1s) (σ*1s) तथा
He2 की आबंध कोटि = \(\frac { 1 }{ 2 } \) (2 – 2) = 0
चूँकि He2 के लिए आबंध कोटि शून्य है, अत: यह अणु अस्थायी होगा अर्थात् इसका अस्तित्व नहीं होगा।
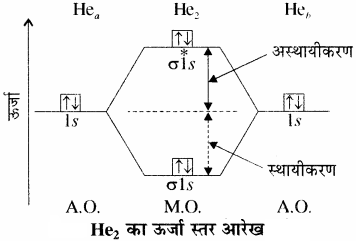
He2+ आयन या H – He अणु में तीन इलेक्ट्रॉन होते हैं अतः इनका इलेक्ट्रॉनिक विन्यास (σ1s)2 (σ*1s)1 होगा तथा बन्ध क्रम का मान = \(\frac { 1 }{ 2 } \) [2-1] = \(\frac { 1 }{ 2 } \) होगा अतः ये He2 से अधिक स्थायी होते हैं तथा इनमें एक अयुग्मित इलेक्ट्रॉन उपस्थित होने के कारण ये अनुचुम्बकीय होते हैं।
(3) लीथियम अणु:
लीथियम परमाणु का इलेक्ट्रॉनिक विन्यास 1s2 2s1 होता है। इसलिए Li2 अणु का इलेक्ट्रॉनिक विन्यास निम्न होगा –
Li2: (σ1s)2 (σ*1s)2 (σ2s)2
इस विन्यास को KK (σ2s)2 द्वारा भी प्रदर्शित किया जाता है। क्योंकि यहाँ प्रथम कोश (K) का बन्ध बनाने में कोई योगदान नहीं है। तथा यहाँ KK, पूर्ण K कोश संरचना [(σ1s)2 (σ*1s)2] को दर्शाता है।
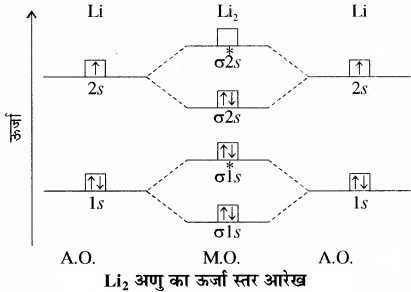
Li2 अणु के इलेक्ट्रॉनिक विन्यास से स्पष्ट है कि इसमें चार इलेक्ट्रॉन बन्धी आण्विक कक्षकों में तथा दो इलेक्ट्रॉन विपरीत आण्विक कक्षक में उपस्थित हैं। अतः इसकी आबंध कोटि = \(\frac { 1 }{ 2 } \) (4 – 2) = 1 होगी। अतः Li2 अणु स्थायी है। चूंकि इसमें कोई अयुग्मित इलेक्ट्रॉन नहीं है, इसलिए यह प्रतिचुम्बकीय होगा तथा प्रायोगिक रूप से यह पाया गया है कि वाष्प प्रावस्था में Li2 अणु का अस्तित्व होता है, जो कि प्रतिचुम्बकीय होता है।
(4) Be2 अणु:
बेरिलियम परमाणु का इलेक्ट्रॉनिक विन्यास 1s2 2s2 होता है। दो Be परमाणुओं के कुल 8 इलेक्ट्रॉनों से Be2 का जो अणु बनेगा जिसका ऊर्जा स्तर आरेख नीचे चित्र में दर्शाया गया है –
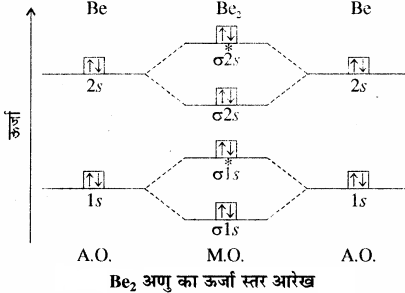
Be2 अणु का इलेक्ट्रॉनिक विन्यास
= (σ1s)2 (σ*1s)2 (σ2s)2 (σ*2s)2
अतः बन्धे क्रम = \(\frac { 1 }{ 2 } \)[4 – 4] = 0
बन्ध क्रम का शुन्य मान यह प्रदर्शित करता है कि बेरिलियम के दो परमाणुओं के मध्य कोई सहसंयोजक बन्ध नहीं बनता है तथा He2 की भाँति Be2 अणु का भी कोई अस्तित्व नहीं होता।
(5) B2 अणु:
बोरॉन परमाणु का इलेक्ट्रॉनिक विन्यास निम्न है – 1s2, 2s2, 2p1। अतः प्रत्येक बोरॉन परमाणु के पास 5 – 5 इलेक्ट्रॉन हैं और B2 अणु में कुल दस इलेक्ट्रॉन हैं।
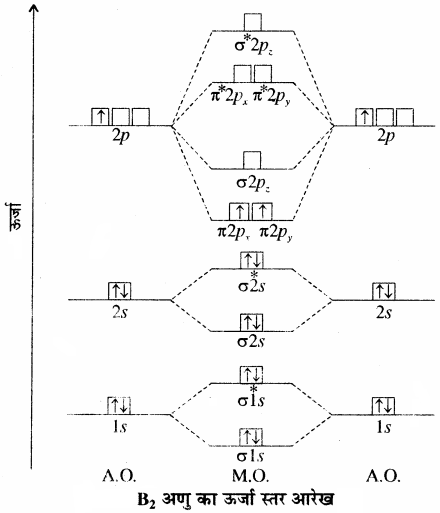
ऊर्जा स्तर आरेख के आधार पर B2 का इलेक्ट्रॉनिक विन्यास निम्न प्रकार होगा –
KK (σ2s)2 (σ*2s)2 (π2px)1(π2py)1
अतः बन्ध क्रम = \(\frac { 1 }{ 2 } \)[6 – 4] = 1
अर्थात् दो बोरॉन परमाणुओं के मध्य एक बन्ध होगा तथा वह π – बन्ध होगा क्योंकि π – बन्धी आण्विक कक्षकों में इलेक्ट्रॉन उपस्थित हैं। अतः इसका अणु सूत्र B – B π होगा। B2 अणु में दो अयुग्मित इलेक्ट्रॉन हैं, अतः इसकी प्रकृति अनुचुम्बकीय होती है।
(6) C2 अणु:
कार्बन परमाणु का इलेक्ट्रॉनिक विन्यास 1s2 2s2 2p2 होता है। अतः C2 के अणु में कुल 12 इलेक्ट्रॉने होंगे। अतः इसका इलेक्ट्रॉनिक विन्यास निम्न होगा –
C2 = (σ1s)2 (σ*1s)2 (σ2s)2 (σ*2s)2 (π2Px2 = π2Py2)
या KK (σ2s)2 (σ*2s)2 (π2Px2 = π2Py2) तथा
आबंध कोटि = \(\frac { 1 }{ 2 } \)(8 – 4) = 2
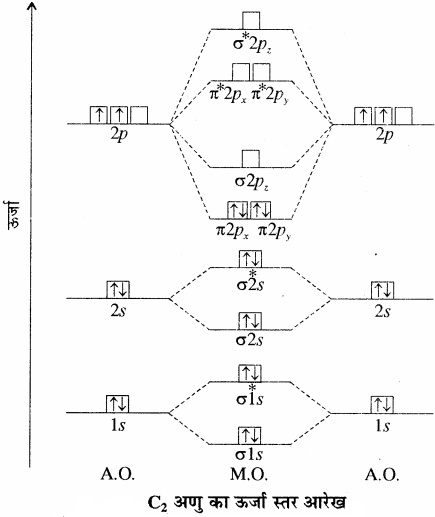
अणु का ऊर्जा स्तर आरेख ऊर्जा स्तर आरेख से सिद्ध होता है कि C2 में कोई अयुग्मित इलेक्ट्रॉन उपस्थित नहीं है अतः इसे प्रतिचुम्बकीय होना चाहिए तथा वास्तव में वाष्प अवस्था में C2 प्रतिचुम्बकीय होता है तथा C2 के अणुओं में दोनों आबंध पाई – आबंध होते है, (\({ C }\frac { \pi }{ \pi } { C }\)) क्योंकि दोनों π आबंधन आण्विक कक्षकों में चार इलेक्ट्रॉन उपस्थित होते हैं, जबकि सामान्यतः अणुओं में द्वि – आबंध, एक सिग्मा तथा एक पाई आबंध से बना होता है।
(7) N2 अणु:
नाइट्रोजन परमाणु का इलेक्ट्रॉनिक विन्यास 1s2 2s2 2px1 2py1 2pz1 होता है।
ऊर्जा स्तर आरेख के आधार पर N2 का इलेक्ट्रॉनिक विन्यास निम्न प्रकार होगा
= (σ1s)2 (σ*1s)2 (σ2s)2 (σ*2s)2 (π2px2)
= (π2py)2 (σ2pz)2
तथा आबन्ध कोटि = \(\frac { 1 }{ 2 } \)(Nb – Na)
= \(\frac { 1 }{ 2 } \)(10 – 4) = 3[latex]{ N }\frac { \frac { \pi }{ \sigma } }{ \pi } { N }[/latex]
अतः दो नाइट्रोजन परमाणुओं के मध्य एक σ तथा दो π बन्ध होते हैं। N2 अणु में कोई अयुग्मित इलेक्ट्रॉन नहीं है, अतः इसकी प्रकृति प्रतिचुम्बकीय (Diamagnetic) होती है।
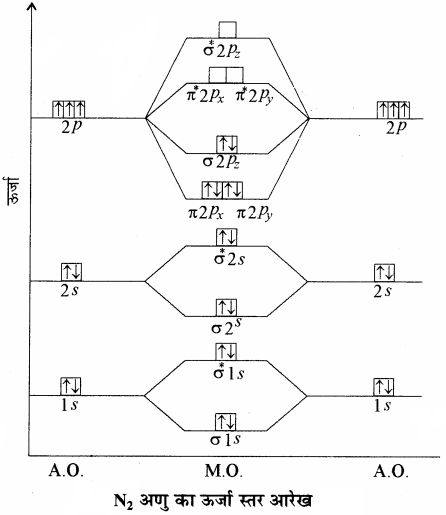
यदि N2 अणु में से एक इलेक्ट्रॉन को कम किया जाए, तो वह बन्धी अणु कक्षक में से निकलेगा अतः N2+ का बन्ध क्रम 2.5 रह जाएगा और इसका व्यवहार भी अनुचुम्बकीय हो जाएगा तथा N2– बनाने के लिए N2 में एक इलेक्ट्रॉन जोड़ना पड़ेगा अतः इसका बन्ध क्रम भी 2.5 ही होगा तथा यह भी अनुचुम्बकीय है। लेकिन N22-का बन्ध क्रम 2 होगा तथा यह अनुचुम्बकीय है। अतः इनके स्थायित्व का क्रम निम्न प्रकार होगा –
![]()
(8) O2 – अणु:
ऑक्सीजन परमाणु का इलेक्ट्रॉनिक विन्यास 1s2 2s2 2p4 होता है। प्रत्येक ऑक्सीजन परमाणु में 8 इलेक्ट्रॉन होते हैं अतः ऑक्सीजन अणु में कुल 16 इलेक्ट्रॉन होंगे।

उपरोक्त ऊर्जा स्तर आरेख के आधार पर O2 का इलेक्ट्रॉनिक विन्यास निम्न प्रकार होगा –
O2 = (σ1s)2(σ*1s)2 (σ2s)2 (σ*2s)2 (σ2pz)2 (π2px2 =π2py2) (π*2px1 = π*2py1)
अथवा O2 = KK (σ2s)2 (σ*2s)2 (σ2pz)2 (π2px2 =π2py2) (π*2px1 = π*2py1)
तथा आबन्ध कोटि = \(\frac { 1 }{ 2 } \)(Nb – Na)
= \(\frac { 1 }{ 2 } \) (10 – 6) = 2
अतः O2 अणु में ऑक्सीजन परमाणु एक द्वि – आबंध द्वारा जुड़े होते है। (\({ O }\frac { \sigma }{ \pi } { O }\))। ऑक्सीजन अणु के π*2px तथा π*2py आण्विक कक्षकों में एक – एक अयुग्मित इलेक्ट्रॉन उपस्थित है, इसलिए ऑक्सीजन अणु को अनुचुम्बकीय होना चाहिए तथा प्रायोगिक तौर पर भी ऐसा पाया गया है। इस प्रकार आण्विक कक्षक सिद्धान्त से ऑक्सीजन के अनुचुम्बकीय व्यवहार की व्याख्या की जा सकती है। जिसे संयोजकता बन्ध सिद्धान्त के आधार पर नहीं समझाया जा सका था।
O2 के आयन:
1. O2+ आयन:
यदि O2 अणु में से एक इलेक्ट्रॉन कम कर दिया जाए तो O2+ आयन बनेगा, स्वाभाविक है कि वह इलेक्ट्रॉन उसके π – विपरीत बन्धी कक्षक में से निकलेगा और तब उसका विन्यास निम्न प्रकार हो जाएगा – KK (σ2s)2 (σ*2s)2 (σ2pz)2 (π2px)2 (π2py)2 (π*2px)1
अतः बन्ध क्रम = \(\frac { 10-{ 5 } }{ 2 } \) = 2.5
इसका बन्ध क्रम O2 अणु से अधिक है अतः इसकी बन्ध लम्बाई का मान O2 से कम हो जाता है। इसके अतिरिक्त O2 अणु में विपरीत बन्धी कक्षकों में दो अयुग्मित इलेक्ट्रॉन हैं जबकि O2+ में केवल एक अयुग्मित इलेक्ट्रॉन है जो कि O2 के अस्थायित्व को प्रदर्शित करता है। अतः O2+ आयन O2 अणु से अधिक स्थायी होता है तथा यह भी अनुचुम्बकीय है।
2. O2– आयन:
O2– आयन से तात्पर्य है कि O2 अणु में एक इलेक्ट्रॉन और जुड़ जाए, स्वाभाविक है कि यह इलेक्ट्रॉन भी विपरीत बन्धी, कक्षक में ही जाएगा अतः इसका विन्यास निम्न प्रकार होगा –
KK (σ2s)2 (σ*2s)2 (σ2pz)2 (π2px)2 (π2py)2 (π*2px)2 (π*2py)1
अतः O2 आयन का बन्ध क्रम = \(\frac { 10-{ 7 } }{ 2 } \) = 1.5
अर्थात् इसका बन्ध क्रम O2 अणु से कम है अतः इसकी बन्ध दूरी का मान O2 से अधिक हो जाता है। इसके अतिरिक्त विपरीत बन्धी कक्षकों में इलेक्ट्रॉनों की संख्या में भी वृद्धि हो गयी अतः O2 का स्थायित्व O2 से कम हो जाता है तथा यह भी अनुचुम्बकीय ही है।
3. O22- आयन:
O2– आयन में एक ओर इलेक्ट्रॉन जोड़ दिया जाए तो O22- आयन बनता है तथा इसका बन्ध क्रम एक ही रह जाएगा और विपरीत बन्धी कक्षकों में इलेक्ट्रॉनों की संख्या बढ़ जाने से O22- का स्थायित्व और भी कम हो जाएगा, इसका इलेक्ट्रॉनिक विन्यास निम्न प्रकार होता है –
KK (σ2s)2(σ*2s)2(σ2pz)2(σ2px)2(π2py)2 (π*2px)2(π*2py)2
अतः बन्ध क्रम = \(\frac { 10-{ 8 } }{ 2 } \) = 1
O22- में सभी इलेक्ट्रॉन युग्मित होने के कारण यह प्रतिचुम्बकीय होता है।
अतः O2 तथा इसके विभिन्न आयनों की तुलना निम्न प्रकार है –

(9) F2 अणु:
फ्लुओरीन परमाणु का इलेक्ट्रॉनिक विन्यास निम्न है –
1s2 2s2 2px2 2py2 2pz1
अंत: F2 के संयोजकता कोशों में कुल 14 इलेक्ट्रॉन होंगे जिनसे विपरीत बन्धी कक्षकों (σ*2pz) के अतिरिक्त समस्त आण्विक कक्षक पूर्ण रूप से भरे हुए होंगे।
अतः F2 का इलेक्ट्रॉनिक विन्यास निम्न प्रकार होगा –
=(σ2s)2 (σ*2s)2(σ2pz)2(π2px)2(π2py)2(π*2px)2(π*2py)2
इसका बन्ध क्रम = \(\frac { 10-{ 8 } }{ 2 } \) = 1
अतः इसका अणु सूत्र F – F होगा एवं इसमें अयुग्मित इलेक्ट्रॉन नहीं होने के कारण इसकी प्रकृति प्रतिचुम्बकीय (Diamagnetic) होगी। विपरीत बन्धी आण्विक कक्षकों में अधिक इलेक्ट्रॉन होने के कारण इसका स्थायित्व कम होता है और इसीलिए इसकी बन्ध ऊर्जा का मान कम होता है।
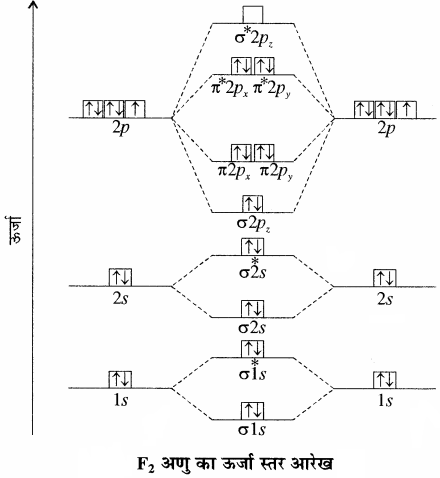
इस प्रकार आवर्त सारणी के द्वितीय आवर्त के समनाभिकीय द्विपरमाणुक अणुओं (B2 से Ne2) के आण्विक कक्षक तथा उनके आण्विक गुणों का संक्षेप में वर्णन अग्र प्रकार है
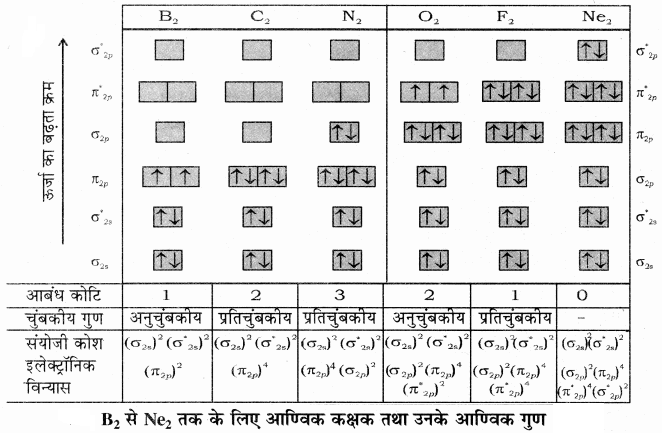
N2, C2, H2- तथा N2- में आबन्ध कोटि क्रमशः 3, 2, 0.5 तथा 2.5 है।