Rajasthan Board RBSE Class 11 Chemistry Chapter 6 ऊष्मागतिकी
RBSE Class 11 Chemistry Chapter 6 पाठ्यपुस्तक के अभ्यास प्रश्न
RBSE Class 11 Chemistry Chapter 6 वस्तुनिष्ठ प्रश्न
प्रश्न 1.
आदर्श गैस के समतापी प्रसार के समय इसकी –
(अ) आन्तरिक ऊर्जा बढ़ती है।
(ब) एन्थैल्पी घटती है।
(स) एन्थैल्पी अप्रभावित रहती है।
(द) एन्थैल्पी घटकर शून्य हो जाती है।
प्रश्न 2.
आन्तरिक ऊर्जा है –
(अ) आंशिक स्थितिज तथा आंशिक गतिज
(ब) पूरी तरह से गतिज
(स) पूरी तरह से स्थितिज
(द) इनमें से कोई नहीं।
प्रश्न 3.
किसी अवस्था में पदार्थ की एन्ट्रॉपी अधिकतम होगी –
(अ) ठोस
(ब) द्रव
(स) गैस
(द) सभी में समान
प्रश्न 4.
एक कार्यों इंजन का स्रोत 500 K पर है तथा सिंक 300 K पर है। इस इंजन की दक्षता होगी –
(अ) 0.2
(ब) 0.4
(स) 0.6
(द) 0.3
प्रश्न 5.
निम्नलिखित में किस अभिक्रिया में उदासीनीकरण ऊष्मा अधिकतम होगी –
(अ) NH4OH तथा CH3COOH
(ब) NH4OH तथा HCl
(स) NaOH तथा CH3COOH
(द) NaOH तथा HCl
उत्तर-तालिका:
1. (द)
2. (अ)
3. (स)
4. (ब)
5. (द)
RBSE Class 11 Chemistry Chapter 6 अतिलघूत्तरात्मक प्रश्न
प्रश्न 6.
क्या ब्रह्माण्ड की एन्ट्रॉपी स्थिर है?
उत्तर:
नहीं, ब्रह्माण्ड की एन्ट्रॉपी स्थिर नहीं है, बल्कि धीरे – धीरे बढ़ रही है।
प्रश्न 7.
ऊष्मागतिकी का प्रथम व द्वितीय नियम संयुक्त रूप से परिभाषित कीजिये।
उत्तर:
प्रथम नियमानुसार ऊर्जा को न तो उत्पन्न किया जा सकता है एवं न ही नष्ट किया जा सकता है। यद्यपि एक प्रकार की ऊर्जा को दूसरी प्रकार की ऊर्जा में परिवर्तित किया जा सकता है। जबकि द्वितीय नियमानुसार ब्रह्माण्ड की एन्ट्रॉपी लगातार बढ़ रही है, इसकी सहायता से ऊर्जा के स्थानान्तरण की दिशा स्वतः प्रक्रम एवं ऊष्मा ऊर्जा के कार्य में परिवर्तन की गणना की जा सकती है।
प्रश्न 8.
किसी आदर्श गैस के एक मोल के लिए आन्तरिक ऊर्जा का मान क्या होगा?
उत्तर:
U = \(\frac{3}{2}\)
NKT
यहाँ
U = आन्तरिक ऊर्जा
N = गैस के परमाणुओं की संख्या
K = बोल्ट्जमान स्थिरांक
T = ताप
प्रश्न 9.
निर्वात में प्रसरण होने पर गैस द्वारा ऊर्जा का अवशोषण या उत्सर्जन क्यों नहीं होता?
उत्तर:
आदर्श गैस में अणुओं के मध्य अन्तरा, आण्विक बल लगभग नगण्य होते हैं तथा इनका निर्वात में प्रसरण होते समय कोई बाह्य बल नहीं लगता है अतः आदर्श गैस के निर्वात में प्रसरण के समय न तो ऊर्जा का अवशोषण होता है और न ही उत्सर्जन होता है।
प्रश्न 10.
बन्ध ऊर्जा, बन्ध वियोजन ऊर्जा के बराबर कब होगी?
उत्तर:
द्विपरमाणुक अणुओं की बन्ध ऊर्जा एवं बन्ध वियोजन ऊर्जा समान होती है।
प्रश्न 11.
ऊष्मीय ऊर्जा में परिवर्तन से आन्तरिक ऊर्जा में परिवर्तन नहीं होता किन्तु एन्थैल्पी में परिवर्तन क्यों होता है?
उत्तर:
आन्तरिक ऊर्जा तंत्र की प्रारम्भिक एवं अन्तिम अवस्थाओं पर निर्भर करती है। अवस्था पथ के परिवर्तन के पथ पर निर्भर नहीं करती है। अतः ऊष्मीय ऊर्जा में परिवर्तन से आन्तरिक ऊर्जा में परिवर्तन नहीं होता है, जबकि एन्थैल्पी आन्तरिक ऊर्जा तथा दाबआयतन ऊर्जा के योग के बराबर होती है। अतः ऊष्मीय ऊर्जा से आयतन में परिवर्तन के कारण एन्थैल्पी में परिवर्तन होता है।
प्रश्न 12.
अस्वत:प्रवर्तित प्रक्रिया को स्वत:प्रवर्तित कैसे बनाया जा सकता है?
उत्तर:
धनात्मक एन्ट्रॉपी परिवर्तन की अभिक्रिया जो कम ताप पर अस्वतःप्रवर्तित होती है एवं उच्च ताप पर स्वत:प्रवर्तित होगी।
प्रश्न 13.
समतापी और रुद्धोष्म प्रक्रम में अन्तर बताइये।
उत्तर:
समतापीय प्रक्रम के प्रत्येक पद में निकाय का ताप स्थिर रहता है जबकि रुद्धोष्म प्रक्रम में निकाय के ताप में परिवर्तन होता है। यदि ऊष्माक्षेपी अभिक्रिया होने पर निकाय का ताप बढ़ जाता है एवं ऊष्माशोषी अभिक्रिया में निकाय का ताप कम हो जाता है।
प्रश्न 14.
आन्तरिक ऊर्जा में परिवर्तन अवस्था फलन है, किन्तु कार्य अवस्था फलन नहीं है, क्यों?
उत्तर:
आन्तरिक ऊर्जा निकाय की अवस्था पर निर्भर करती है न कि अवस्था परिवर्तन के पथ पर। अतः यह एक अवस्था फलन है, परन्तु कार्य द्वारा किसी तन्त्र की ऊर्जा में परिवर्तन किया जाता है। अतः निकाय को ऊर्जा में भी परिवर्तन हो जाता है अतः कार्य अवस्था फलन नहीं है।
प्रश्न 15.
हीरे तथा ग्रेफाइट में से किसकी एन्ट्रॉपी अधिक होती है?
उत्तर:
ग्रेफाइट की हीरे से अधिक एन्ट्रॉपी होती है।
प्रश्न 16.
E तथा H में क्या सम्बन्ध है?
उत्तर:
H = E + PΔV
H = एन्थैल्पी
E = आन्तरिक ऊर्जा
P = दाब
ΔV = आयतन में परिवर्तन
प्रश्न 17.
पदार्थ की अधिकतम एन्ट्रॉपी किस अवस्था में होगी?
उत्तर:
पदार्थ की अधिकतम एन्ट्रॉपी गैस अवस्था में होती है।
प्रश्न 18.
ऊष्माक्षेपी तथा ऊष्माशोषी अभिक्रिया के उदाहरण दीजिये।
उत्तर
CH4(g) + 2O2(g) → CO2(g) + 2H2O (l)
ΔH = – 890.35 kJ ऊष्माक्षेपी
N2(g) + O2(g) → 2NO(g)
ΔH = + 180 kJ ऊष्माशोषी
प्रश्न 19.
NH4OH तथा HCl की उदासीनीकरण ऊष्मा कितनी होती है?
उत्तर:
NH4OH एक दुर्बल क्षार है, जबकि HCl एक प्रबल अम्ल है। अतः इनकी उदासीनीकरण ऊष्मा 51.46 kJ उत्पन्न होती है।
प्रश्न 20.
गिब्स हेल्मोल्ट्ज समीकरण लिखिये।
उत्तर:
ΔG = ΔH – TΔS
ΔG = गिब्स ऊर्जा में परिवर्तन
ΔH = एन्थैल्पी में परिवर्तन
ΔS = एन्ट्रॉपी में परिवर्तन
T = परमताप लघूत्तरात्मक
RBSE Class 11 Chemistry Chapter 6 लघूत्तरात्मक प्रश्न
प्रश्न 21.
यदि कार्यों इंजन का स्रोत 500 k तथा सिंक 300 k पर है तो इस इंजन की दक्षता क्या होगी?
हल –
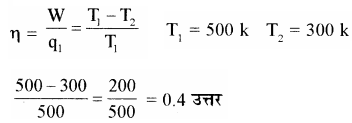
प्रश्न 22.
रुद्धोष्म प्रक्रम होने के लिए क्या परिस्थिति आवश्यक है?
उत्तर:
इस प्रक्रम में तन्त्र न तो पारिपार्श्विक से ऊष्मा ग्रहण कर सकता है और न ही वह पारिपार्श्विक को ऊष्मा दे सकता है अर्थात् इसमें ऊष्मा स्थिर रहती है। अतः यदि कोई परिवर्तन ऊष्माशोषी है तो उस परिवर्तन से तन्त्र का ताप गिर जाएगा और यदि कोई परिवर्तन ऊष्माक्षेपी है तो तन्त्र का ताप बढ़ जायेगा।
प्रश्न 23.
प्रबल अम्ल व अम्ल क्षार की उदासीनीकरण ऊष्मा निश्चित होती है, क्यों?
उत्तर:
प्रबल अम्ल एवं प्रबल क्षार से प्राप्त लवण जल में पूर्ण आयनित होते हैं, अतः इनके उदासीनीकरण प्रक्रिया में केवल एक ही क्रिया होती है। H+ व OH- आयनों के संयोग से अनआयनित जल का बनना अतः प्रत्येक प्रबल अम्ल व प्रबल क्षार के उदासीनीकरण ऊष्मा का मान समान रहता है जो – 13.7 Kcal या – 57.32 kJ होती है।
HCL (aq) + KO4 (aq) → KCl (aq) + H2O (l)
ΔH = – 57.45 kJ
HNO3 (aq) + NaOH (aq) → NaNO3 (aq) + H2O (l)
ΔH = – 57.28 kJ
प्रश्न 24.
NaCl का जल में घुलना एक ऊष्माशोषी प्रक्रम है, फिर भी यह पानी में घुल जाता है। समझाइये।
उत्तर:
किसी आयनिक यौगिक [AB(s)] को जल में घोलने पर हुए विभिन्न परिवर्तनों को निम्न प्रकार दर्शाया जा सकता है –
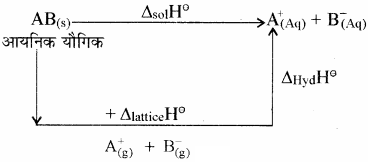
अत: हेस के नियम से –
ΔsolH⊝ = ΔlatticeH⊝ + ΔhydH⊝
यहाँ
ΔlatticeH⊝ = +ve
तथा
ΔhydH⊝ = -ve होती है।
NaCl(s) की जलयोजन एन्थैल्पी का मान (ΔhydH⊝) – 784 kJ mol-1 तथा इसकी जालक एन्थैल्पी (ΔlatticeH⊝) का मान + 788 kJ mol-1 होता है। अतः ΔsolH⊝ = 788 kJ mol-1 – 784 kJ mol-1 = + 4 kJ mol-1 अतः NaCl(s) की विलयन बनने की प्रक्रिया में ऊर्जा परिवर्तन बहुत कम होता है तथा यह एक ऊष्माशोषी प्रक्रम है।
अधिकांश आयनिक यौगिकों के लिए ΔsolH⊝ का मान धनात्मक होता है। (ऊष्माक्षेपी प्रक्रम) अतः ताप बढ़ाने पर आयनिक यौगिकों की जल में विलेयता बढ़ती है। जब किसी यौगिक के लिए जालक एन्थैल्पी का मान बहुत अधिक होता है तो वह यौगिक जल में अविलेय होगा।
प्रश्न 25.
निम्न अभिक्रिया में NH3 गैस की मानक विरचन एन्थैल्पी ज्ञात कीजिये।
N2 (g) + H2 (g) → 2NH3 (g) यदि (H°r = – 92.4 kJ mol-1)
हल –
अभिक्रिया में 2 मोल NH3 बन रही है तथा हमें एक मोल NH3 बनने की मानक विरचन एन्थैल्पी ज्ञात करनी है।
अतः Δf = H° (NH3)(g)
= ![]()
= (- \(\frac { { – }94.2 }{ 2 } \))
= – 46.2 kJ mol-1 उत्तर
प्रश्न 26.
यदि कार्बन की दहन ऊष्मा का मान -393.5 kJ mol-1 है तो कार्बन व ऑक्सीजन से 35.2 g CO2 बनने पर उत्सर्जित ऊष्मा की गणना कीजिये।
उत्तर:
C के दहन की अभिक्रिया निम्न प्रकार होगी –
C (g) + O2 (g) → CO2 (g) ΔcH = – 393.5 kJ mol-1
1 मोल CO2 = 44 g CO2
अतः 44 g CO2 के बनने पर उत्सर्जित ऊष्मा = 393.5 kJ अत: 35.2 g CO2 के बनने पर उत्सर्जित ऊष्मा
= 393.5 × \(\frac { 35.2 }{ 44 } \)
= 314.8 kJ उत्तर
प्रश्न 27.
एक प्रक्रम में निकाय द्वारा 701 J ऊष्मा अवशोषित होती है एवं 394 J कार्य किया जाता है। इस प्रक्रम में आन्तरिक ऊर्जा में कितना परिवर्तन होगा?
हल –
W = – 394 J
q = 701 J
ऊष्मागतिकी के प्रथम नियमानुसार
ΔU = q + W
ΔU = 701 + (- 394)
= 307 J
प्रश्न 28.
एक विलगित निकाय के लिए U = 0 है। इसके लिए S क्या होगा?
उत्तर:
U = 0 वाले विलगित निकाय के लिए S > 0 होगा। अतः अभिक्रिया स्वतः प्रवर्तित होगी। उदाहरण-गैसों का मिश्रण बनना, U = 0 लेकिन S > 0 (+ve) क्योंकि गैसों का मिश्रण बनने पर अव्यवस्था (एन्ट्रॉपी) बढ़ती है।
प्रश्न 29.
एक निकाय 5 kJ ऊष्मा अवशोषित करता है और 1 kJ कार्य करता है। निकाय में आन्तरिक ऊर्जा में परिवर्तन की गणना कीजिए।
हल –
W = – 1 kJ
q = 5 kJ
ऊष्मागतिकी के नियमानुसार
ΔU = q + W
ΔU = 5 + (- 1 kJ)
ΔU = 4 kJ उत्तर
प्रश्न 30.
2Cl → Cl2 (g) इस अभिक्रिया के लिये ΔH तथा ΔS के चिह्न क्या होंगे?
उत्तर:
इस अभिक्रिया के लिए ΔH = (- ve) क्योंकि बन्ध बनने पर ऊर्जा उत्सर्जित होती है (ऋणात्मक), ΔS = (- ve) क्योंकि एन्ट्रॉपी का मान कम हो रहा है। (ऋणात्मक) क्योंकि परमाणु मिलकर अणु बना रहे हैं तथा अणुओं में। अव्यवस्था परमाणुओं की तुलना में कम होती है।
प्रश्न 31.
एक विलगित निकाय का उदाहरण दें।
उत्तर:
वह निकाय जो अपने परिवेश से ऊर्जा तथा द्रव्यमान दोनों का ही विनिमय नहीं करता है, उसे विलगित निकाय कहते हैं।
उदाहरण:
थर्मस में रखा गर्म जल (जलवाष्प निकाय)। इससे न तो ऊर्जा एवं न ही द्रव्यमान का अपने परिवेश से विनिमय हो पाता है, इसलिए यह एक विलगित निकाय है।
प्रश्न 32.
निकाय के कौनसे प्रक्रम में ताप में कमी होती है?
उत्तर:
बन्द निकाय में ताप में कमी होती है। इस निकाय में परिवेश से ऊर्जा का विनिमय तो हो सकता है लेकिन द्रव्य का विनिमय नहीं होता है।
उदाहरण – एक बन्द पात्र में रखा गर्म जल।
प्रश्न 33.
267 और 276 k ताप पर बर्फ के गलने के लिए G का चिह्न क्या होगा? (बर्फ का गलनांक = 273 k)
हल –
जब बर्फ पिघलती है तो ऊर्जा ग्रहण करती है अर्थात् अणुओं के अनियातंकीकरण अधिक हो जाती है, जिससे ΔS (एन्ट्रॉपी) बढ़ जाती है।
ΔG = ΔH – ΔS यदि ताप बढ़ता है तो ΔG का मान – ve हो जाता है।
प्रश्न 34.
25°C पर 4 ग्राम गैसीय हाइड्रोजन को मुक्त गैसीय परमाणु में वियोजित करने के लिए आवश्यक ऊर्जा 208 Kcal है। तो H – H बन्ध की बन्ध ऊर्जा क्या होगी?
उत्तर:
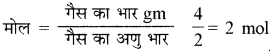
2 मोल हाइड्रोजन को वियोजित करने के लिए आवश्यक ऊर्जा 208 Kcal है।
तो 1 मोल के लिए \(\frac { 208 }{ 2 } \) = 104 Kcal
अर्थात् H – H बन्ध की बन्ध ऊर्जा 104 Kcal होगी।
प्रश्न 35.
ΔH एवं ΔE के मध्य सम्बन्ध बताओ।
उत्तर:
ΔH = ΔE + PΔV
ΔH = एन्थैल्पी में परिवर्तन
ΔE = आन्तरिक ऊर्जा में परिवर्तन
ΔV = आयतन में परिवर्तन
P = दाब
RBSE Class 11 Chemistry Chapter 6 निबन्धात्मक प्रश्न
प्रश्न 36.
ऊष्मागतिकी के प्रथम नियम की व्याख्या कीजिए तथा इसकी कमियां बताइये।
उत्तर:
ऊष्मागतिकी के प्रथम नियम:
यह ऊर्जा संरक्षण का नियम है तथा यह नियम रॉबर्टमेयर व हेल्महोल्ट्ज़ द्वारा दिया गया था। इस नियम के अनुसार ऊर्जा को न तो उत्पन्न किया जा सकता है, और न ही इसे नष्ट किया जा सकता है। यद्यपि एक प्रकार की ऊर्जा को दूसरी प्रकार की ऊर्जा में परिवर्तित किया जा सकता है। इस नियम का कोई अपवाद नहीं है। ऊष्मागतिकी के प्रथम नियम के अन्य कथन निम्नलिखित हैं –
- ब्रह्माण्ड की कुल ऊर्जा निश्चित होती है अर्थात् किसी निकाय तथा उसके परिवेश की कुल ऊर्जा स्थिर रहती है।
- किसी प्रक्रम में यदि ऊर्जा के किसी रूप की निश्चित मात्रा लुप्त होती है तो उसके तुल्य मात्रा में ऊर्जा दूसरे रूप में उत्पन्न हो जाती है।
- एक विलगित निकाय की ऊर्जा स्थिर होती है।
- एक ऐसा शाश्वत गति यंत्र का निर्माण संभव नहीं है जो कि तुल्य मात्रा में ऊर्जा व्यय बिना, उतने ही कार्य कर सके।
ऊष्मागतिकी के प्रथम नियम का गणितीय रूप:
किसी निकाय की आन्तरिक ऊर्जा में वृद्धि दो प्रकार से की जा सकती है – निकाय को ऊष्मा देकर तथा निकाय पर कार्य करके। माना कि किसी गैसीय निकाय की प्रारम्भिक अवस्था में उसकी आन्तरिक ऊर्जा U1 है, यह निकाय ऊष्मा O की कुछ मात्रा (q) अवशोषित करता है तथा इस पर कार्य (w) किया जाता है। इसकी आन्तरिक ऊर्जा U2 हो जाती है। अत: निकाय की ऊर्जा में वृद्धि (ΔU) —
ΔU = U2 – U1
जब आन्तरिक ऊर्जा में परिवर्तन दोनों प्रकारों के कार्य द्वारा एवं ऊष्मा स्थानान्तरण द्वारा हो तो आन्तरिक ऊर्जा में परिवर्तन दोनों कार्य व ऊष्मा के योग के समान होगा जिसे निम्न प्रकार से व्यक्त किया जा सकता है –
ΔU = q + w यह समीकरण ऊष्मागतिकी का प्रथम नियम का गणितीय रूप है। यहाँ q एवं W अवस्था फलन नहीं है, लेकिन ΔU एक अवस्था फलन है।
- यदि कार्य व ऊष्मा शून्य हो तो कोई ऊर्जा परिवर्तन नहीं होगा
w = 0 एवं q = 0 तो ΔU = 0
अतः एक विलगित निकाय की ऊर्जा अपरिवर्तनीय होती है। - जब निकाय द्वारा प्रसार कार्य किया जाता है तो
w = – PΔV
अतः
ΔU = q – PΔV
या
q = ΔU – PΔV - जब निकाय पर कार्य किया जाता है अर्थात् संपीडन कार्य होता है, तो –
अतः
w = PΔV
अतः
ΔU = q + PΔV
q = ΔU – PΔV - यदि आयतन में कोई परिवर्तन नहीं होता है तो अवशोषित ऊष्मा केवल निकाय की आन्तरिक ऊर्जा में वृद्धि करती है।
ΔV = 0 (स्थिर आयतन पर)
q = qv
qv = ΔV
समतापीय अनुत्क्रमणीय प्रक्रम में
ΔU = 0
अतः
q = – w = Pex (Vf -Vi)
Vf = अन्तिम आयतन
Vi = प्रारम्भिक आयतन
समतापीय उत्क्रमणीय प्रक्रम के लिए
q = – w
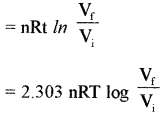
रुद्धोष्म प्रक्रम के लिए
q = 0
अतः
ΔU = Wad
एन्थैल्पी:
किसी प्रक्रम को स्थिर दाब पर सम्पन्न कराने के लिए हम एक अन्य ऊष्मागतिकी फलन का उपयोग करते हैं, जिसे H द्वारा प्रदर्शित करते हैं और इसे तन्त्र की अन्तर्निहित ऊष्मा अथवा एन्थैल्पी कहते हैं। सामान्यतया रासायनिक अभिक्रियाएँ खुले पात्र में होती हैं अर्थात् वायुमण्डलीय दाब स्थिर होता है। इस समय निकाय में होने वाले ऊष्मा परिवर्तन स्थिर आयतन में होने वाले परिवर्तन (qv = U) से अलग होते। हैं। अतः स्थिर दाब पर ऊष्मा परिवर्तन को समझाने के लिए ऊष्मागतिकी फलन (H) एन्थैल्पी दिया गया है। इसे समाहित ऊष्मा भी कहते हैं।
स्थिर दाब प्रक्रम में यदि केवल दाब आयतन कार्य ही किया जाए। तो ऊष्मागतिकी के प्रथम नियमानुसार
ΔU = qp – PΔV
qp = ΔU + PΔV
qp = (U2 – U1) + P (V2 – V1)
दाब स्थिर होने पर q को qp से प्रदर्शित करते हैं।
अतः qp = (U2 + PV2) – (U1 + PV1)
यहाँ U, P एवं V अवस्था फलन हैं एवं (U + PV) भी एक अवस्था फलन है जिसे एन्थैल्पी (H) या समाहित ऊष्मा कहते हैं।
H = U + PV
अतः किसी निकाय की एन्थैल्पी उसमें उपस्थित कुल ऊर्जा होती है जो कि आन्तरिक ऊर्जा एवं दाब – आयतन ऊर्जा के योग के बराबर होती है।
प्रारम्भिक एवं अन्तिम अवस्थाओं में एन्थैल्पी परिवर्तन निम्न प्रकार होता है –
H2 – H1 = U2 – U1 + PV2 – PV1
ΔH = U2 – U1 + PV2 – PV1
ΔH = ΔV + PΔV = qp …..(1)
ΔH = qp
अर्थात् स्थिर दाब पर किसी तन्त्र को दी गई ऊष्मा उस तंत्र के एन्थैल्पी परिवर्तन के बराबर होती है। अतः qp भी एक अवस्था फलन होता है। ठोस व द्रव पदार्थों के आयतन में अधिक परिवर्तन नहीं होता है। अतः ΔV को नगण्य मान सकते हैं।
अर्थात् V1 = V2
अतः
ΔH = ΔU
अर्थात् ठोस एवं द्रव पदार्थों के ΔH वे ΔU के मान लगभग बराबर होते हैं।
उपर्युक्त के विपरीत यदि तंत्र गैसीय अवस्था में हो तो उसके आयतन में परिवर्तन पर्याप्त होता है जिसे नगण्य नहीं मान सकते हैं। माना कि प्रारम्भिक पदार्थ के nA मोलों का कुल आयतन VA है। और अन्तिम पदार्थ के nB मोलों का कुल आयतन VB है। अतः एक आदर्श गैस के लिए
PVA = nART व PVB=nBRT
दोनों समीकरणों से
PVB – PVA = nBRT – nART
P (VB – VA) = RT (nB – nA)
PΔV = RT
Δn = ΔngRT
यहाँ Δng गैसीय उत्पादों के मोलों की संख्या एवं गैसीय अभिक्रियाओं के मोलों की संख्या का अन्तर है।
PΔV का मान समीकरण (1) में रखने पर
ΔH = ΔU + ΔngRT
यहाँ Δng का मान धनात्मक या ऋणात्मक हो सकता है अतः एन्थैल्पी का मान भी आन्तरिक ऊर्जा परिवर्तन से अधिक या कम हो सकता है।
प्रश्न 37.
ऊष्मा रसायन के हेस का नियम एवं इसके अनुप्रयोग लिखिये।
उत्तर:
एन्थैल्पी एक अवस्था फलन है, अतः यह प्रारम्भिक अवस्था (अभिकारक) एवं अन्तिम अवस्था (उत्पाद) पर निर्भर करती है अर्थात् एन्थैल्पी परिवर्तन, अभिक्रिया के पथ पर निर्भर नहीं करता है। अतः यदि किसी रासायनिक अभिक्रिया को एक या एक से अधिक पदों में दो या दो से अधिक विधियों द्वारा सम्पन्न किया जाये तो सम्पूर्ण परिवर्तन में उत्पन्न या अवशोषित ऊष्मा की मात्राएँ समान रहती हैं। अर्थात् कुल ऊष्मा परिवर्तन समान रहता है, चाहे यह अभिक्रिया किसी भी विधि से की जाए। इसे हेस का नियम के रूप में इस प्रकार कहा जा सकता है। हेस का नियम – एक से अधिक पदों में होने वाली किसी रासायनिक अभिक्रिया की मानक एन्थैल्पी उन सभी माध्यमिक अभिक्रियाओं की समान ताप पर मानक एन्थैल्पियों का योग होती है, जिनमें इस सम्पूर्ण अभिक्रिया को विभाजित किया जा सकता है। या कोई रासायनिक अभिक्रिया एक पद में होती है या कई पदों में अभिक्रिया में कुल एन्थैल्पी परिवर्तन हमेशा समान रहता है।
निश्चित ताप व दाब पर अभिकारक A को D में एक पद में बदलने पर ΔH kJ ऊष्मा उत्सर्जित होती है।
यदि एक सामान्य अभिक्रिया A → D के लिए एक पथ से कुल एन्थैल्पी परिवर्तन ΔH हो तथा दूसरे पथ से ΔH1, ΔH2, ΔH3,…. समान उत्पाद D के बनने में विभिन्न एन्थैल्पी – परिवर्तनों को दर्शाते हैं तो
ΔH = ΔH1 + ΔH2 + ΔH3 ….
इसे इस प्रकार भी प्रदर्शित किया जा सकता है –
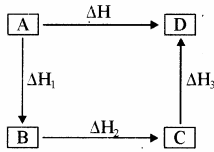
उदाहरण:
ग्रेफाइट के दहन से कार्बन डाइऑक्साइड का बनना –
निम्नलिखित दो विधियों द्वारा सम्पन्न हो सकता है –
1. (एक पद में)
C(s) + O2 → CO2(g)
ΔH = – 94 Kcal
2. दो पदों में
(a) C(s) + \(\frac { 1 }{ 2 } \) O2 → CO(g)
ΔH1 = – 26.4 Kcal
(b) CO(g) +\(\frac { 1 }{ 2 } \) O2 → CO2(g)
ΔH2 = – 67.6 Kcal
समीकरण (a) व (b) को जोड़ने पर
C(s) + O2(g) → CO2(g)
ΔH = ΔH1 + ΔH2 = – 94 Kcal
अतः इन दोनों विधियों में समान मात्रा में ऊष्मा उत्पन्न हो रही है। इससे हेस के नियम की पुष्टि होती है।
हेस के नियम के अनुप्रयोग:
हेस के नियम की सहायता से उन अभिक्रियाओं की ऊष्मा (एन्थैल्पी) की सरलता से गणना की जा सकती है जिनकी ऊष्मा सीधे प्रयोगों द्वारा निर्धारित नहीं की जा सकती है। जैसे यौगिकों की संभवन एन्थैल्पी, दहन एन्थैल्पी, अभिक्रिया की एन्थैल्पी, अपररूपों की संक्रमण (रूपान्तरण) एन्थैल्पी तथा बन्ध ऊर्जा व अनुनाद ऊर्जा इत्यादि।
लेवोशिये तथा लाप्लास का नियम:
किसी यौगिक को उसके अवयवी तत्त्वों से बनाने में जितनी ऊष्मा उत्सर्जित होती है, उतनी ही ऊष्मा, उस यौगिक को उसके तत्त्वों में विघटित करने के लिए आवश्यक होती है।
उदाहरण:
C(s) + O2(g) → CO2(g), ΔH = – 393.5 kJ (ऊष्माक्षेपी अभिक्रिया)
तथा
CO2(g) + C(s) + O2(g), ΔH = + 393.5 kJ (ऊष्माशोषी अभिक्रिया)
हेस का नियम एवं लेवोशियो व लाप्लास का नियम, ऊष्मा रसायन के नियम हैं जो कि ऊष्मागतिकी के प्रथम नियम पर आधारित हैं। ऊष्मा रसायन भौतिक रसायन की वह शाखा है जिसके अन्तर्गत रासायनिक प्रक्रमों में होने वाले ऊर्जा (ऊष्मा) परिवर्तन का अध्ययन किया जाता है।
प्रश्न 38.
कार्बो इंजन की दक्षता द्वारा ऊष्मागतिकी के द्वितीय नियम को समझाइये। मुक्त ऊर्जा परिवर्तन किस प्रकार स्वतः प्रवर्तित प्रक्रम की कसौटी है?
उत्तर:
ऊष्मागतिकी का प्रथम नियम अवशोषित ऊष्मा एवं निकाय द्वारा किये गये कार्य के बीच सम्बन्ध प्रदर्शित करता है। किन्तु ऊष्मा के प्रभाव की दिशा परिवर्तन में ऊर्जा के व्यय का प्रकार का होगा एवं ऊष्मा ऊर्जा को पूर्णतया कार्य में परिवर्तित नहीं किया जा सकता है। ये सभी प्रथम नियम से स्पष्ट नहीं हो सके अतः ऊष्मागतिकी के अन्य नियम की आवश्यकता हुई जिसकी सहायता से ऊर्जा के स्थानान्तरण की दिशा, स्वतः प्रक्रम एवं ऊष्मा ऊर्जा के कार्य में परिवर्तन की गणना की जा सकती है, जिसे ऊष्मागतिकी का द्वितीय नियम कहते हैं। हम जानते हैं कि किसी विलगित निकाय के लिए ऊर्जा परिवर्तन निश्चित होता है। अतः, इस प्रकार के निकाय की एन्ट्रॉपी में वृद्धि स्वत:परिवर्तन की स्वाभाविक दिशा बताती है। वास्तव में यही ऊष्मागतिकी का द्वितीय नियम है। इसके विभिन्न कथन निम्नलिखित हैं –
- सभी स्वतः प्रक्रम (या प्राकृतिक प्रक्रम) अनुत्क्रमणीय होते है।
- किसी भी स्वतः प्रक्रम को बाह्य स्रोत की सहायता के बिना विपरीत दिशा में ले जाना संभव नहीं है। जैसे ऊष्मा स्वत: निम्न ताप की वस्तु से उच्च ताप की वस्तु की ओर प्रवाहित नहीं हो सकती है।
- सभी स्वतः प्रक्रमों में एन्ट्रॉपी बढ़ती है अर्थात् कुल एन्ट्रॉपी परिवर्तन (तंत्र की एन्ट्रॉपी परिवर्तन + परिवेश की एन्ट्रॉपी परिवर्तन) धनात्मक होता है।
- ब्रह्माण्ड की एन्ट्रॉपी लगातार बढ़ रही है।
- किसी विलगित निकाय में अधिकतम एन्ट्रॉपी की अवस्था में स्थायित्व अधिक होता है।
अतः ऊष्मागतिकी के द्वितीय नियम से यह स्पष्ट होता है कि स्वत:प्रवर्तित ऊष्माक्षेपी अभिक्रियाएँ इतनी सामान्य क्यों होती हैं। ऊष्माक्षेपी अभिक्रियाओं से प्राप्त ऊर्जा वातावरण की अव्यवस्था को बढ़ा देती है। अतः कुल एन्ट्रॉपी परिवर्तन धनात्मक होता है जो अभिक्रिया को स्वतःप्रवर्तित कर देता है।
स्वतः प्रक्रम:
वे प्रक्रम जो किसी निकाय में बगैर किसी बाह्य साधन की सहायता से होते हैं, उन्हें स्वतः प्रक्रम कहते हैं। अर्थात् निकाय पर कोई बाह्य कार्य नहीं किया जा सकता है।
उदाहरण –
- द्रव या जल का ऊपर से नीचे की ओर बहना परन्तु बाह्य कार्य द्वारा इसकी दिशा को बदला जा सकता है।
- गैसों का उच्च दाब से निम्न दाब की एक तरफ प्रवाहित होना।
- धातु की छड़ के एक सिरे को गर्म करने पर दूसरा ठण्डा सिरा अपने आप गर्म हो जाता है।
- विद्युत धारा उच्च विभव वाले सिरे से निम्न विभव वाले सिरे की ओर स्वतः प्रवाहित होती है।
इस प्रकार स्पष्ट है कि सभी प्राकृतिक प्रक्रम स्वतः होते हैं। ये बिना किसी बाहरी कार्य की सहायता से सम्पन्न होते हैं। इन्हें अनुत्क्रमणीय प्रक्रम कहते हैं एवं इन्हें बाह्य कार्य करके उत्क्रमणीय बनाया जा सकता है। अतः इस प्रकार स्पष्ट है कि द्वितीय नियमानुसार स्वतः प्रक्रम उसी दिशा में अग्रसर होते हैं, जहाँ वे साम्यावस्था प्राप्त कर सकें एवं उत्क्रमणीय प्रक्रम में अधिकतम कार्य किया जा सकता है। अतः ऊष्मागतिकी का द्वितीय नियम स्वतः प्रक्रम में एन्ट्रॉपी के बढ़ने को स्पष्ट करता है।
(a) क्या एन्थैल्पी का कम होना स्वतःप्रवर्तिता की कसौटी है?
स्वत:प्रवर्तित प्रक्रम जैसे पहाड़ी से जल का गिरना, गैसों का उच्च दाब से निम्न दाब की ओर प्रसारण इत्यादि में प्रक्रम के होने की दिशा में निकाय की स्थितिज ऊर्जा में कमी होती है, अतः एक रासायनिक अभिक्रिया उस दिशा में स्वत:प्रवर्तित होगी, जिस दिशा में ऊर्जा में कमी होगी, जैसा कि ऊष्माक्षेपी अभिक्रियाओं में होता है।
उदाहरण –
1. \(\frac { 1 }{ 2 } \) H (g) + \(\frac { 1 }{ 2 } \) Cl2 (g) → HCl (g)
ΔrH⊝ = – 92.32 kJ mol-1
2. H2 (g) + \(\frac { 1 }{ 2 } \) O2 (g) → H2O (l)
ΔrH⊝ = – 285.8 kJ mol-1
किसी ऊष्माक्षेपी अभिक्रिया में एन्थैल्पी में हुई कमी को निम्न आरेख द्वारा दर्शाया जा सकता है –
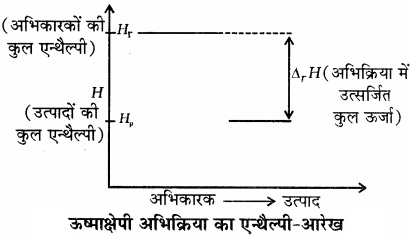
अतः किसी रासायनिक अभिक्रिया के लिए एन्थैल्पी में आई कमी उसका प्रेरक बल (Driving Force) होता है।
उपरोक्त बातों ये यह निष्कर्ष प्राप्त होता है कि ऊष्माक्षेपी अभिक्रियाएँ स्वत:प्रवर्तित होती हैं, लेकिन ऐसी बहुत – सी अभिक्रियाएँ होती हैं जो ऊष्मारोधी होते हुए भी स्वत:प्रवर्तित हैं।
उदाहरण –
1. C(s)(Graphite) + 2S (l) → CS2 (l)
ΔrH⊝ = + 128.5 kJ mol-1
2. N2(g) + O2 (g) → 2NO (g)
ΔrH⊝ = 66.4 kJ mol-1
3. CaCO3 (s) → CaO (s) + CO2 (g)
ΔrH⊝ = + 178 kJ mol-1
ऊष्माशोषी अभिक्रिया को निम्न आरेख द्वारा प्रदर्शित किया जाता है –
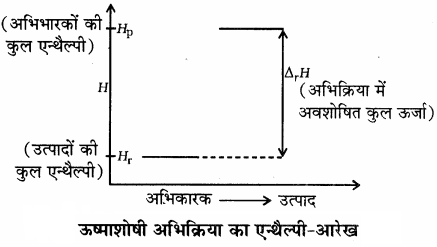
कुछ अभिक्रियाएँ ऐसी भी होती हैं जिनके लिए ΔH = 0 होता है। तथा वे स्वतः होती हैं, जैसे गैसों का मिश्रित होना तथा अम्ल तथा ऐल्कोहॉल से एस्टर का निर्माण इत्यादि। इससे यह स्पष्ट होता है कि एन्थैल्पी में कमी स्वत:प्रवर्तिता के लिए एक सहायक (contributory) कारक है लेकिन यह सभी प्रक्रमों के लिए सत्य नहीं है अर्थात् एन्थैल्पी परिवर्तन के साथ अन्य कारक भी हैं जो प्रक्रम के स्वत: के होने के लिए उत्तरदायी हैं।
(b) एन्ट्रॉपी तथा स्वत: प्रवर्तिता:
एक स्वत:प्रवर्तित प्रक्रम दी गई दिशा में कैसे प्रेरित होता है? इस प्रश्न का उत्तर जानने के लिए हम ऐसे प्रक्रमों का अध्ययन करते हैं। जिनके लिए ΔH = 0 अर्थात् एन्थैल्पी में कोई परिवर्तन नहीं होता फिर भी वे स्वत: प्रवर्तित हैं। जैसे –
1. दो गैसों का एक – दूसरे में विसरण।
प्रयोग:
एक विलगित बन्द पात्र में जब दो गैसों को विसरित करते हैं तो दोनों एक – दूसरे में पूर्ण रूप से मिश्रित हो जाती हैं। यह प्रक्रिया स्वत: प्रवर्तित है। गैसों के मिश्रित होने के बाद निकाय में अव्यवस्था बढ़ जाती है।
2. जल से भरे बीकर में स्याही की बूंद का विसरण तब तक होता है जब तक कि समांगी विलयन न बन जाए। एक विलगित निकाय में, निकाय की ऊर्जा में हमेशा अधिक अव्यवस्थित होने की प्रवृत्ति पायी जाती है। यह एक स्वतः प्रवर्तिता की कसौटी हो सकती है।
प्रश्न 39.
निम्न की व्याख्या कीजिए –
- संभवन एन्थैल्पी
- प्रावस्था परिवर्तन एन्थैल्पी
- एन्ट्रॉपी
- विलायकन एन्थैल्पी।
उत्तर:
1. संभवन एन्थैल्पी:
यह मानक अभिक्रिया एन्थैल्पी की ही एक विशेष स्थिति है जिसमें एक मोल यौगिक अपने तत्वों से बनता है। अतः इसे विरचन एन्थैल्पी भी कहते हैं। किसी यौगिक के एक मोल को उसके अवयवी तत्वों, जो अपने सबसे स्थायी रूपों में लिये गये हैं, से बनाने पर होने वाले मानक एन्थैल्पी परिवर्तन को उसकी मानक मोलर विरचन एन्थैल्पी या मानक संभवन एन्थैल्पी कहते हैं।
N2 (g) + O2 (g) → 2NO(g)
ΔHr° = + 180 kJ
उपरोक्त अभिक्रिया में 2 मोल NO बनाने के लिए अवशोषित ऊष्मा + 180 kJ उसकी अभिक्रिया एन्थैल्पी है। मोल NO बनने में, अवशोषित ऊष्मा NO की विरचन एन्थैल्पी है।
C(s) + 2H2 (g) → CH4(g)
ΔHr° = ΔHf°= \(\frac { -{ 74.8{ { k }{ J } } } }{ M } \)
ΔH° = \(\frac { 180 }{ 2 } \) = \(\frac { { 90{ { k }{ J } } } }{ M } \)
ΔHr°= 2ΔHf°
HBr (g) के लिए –
\(\frac { 1 }{ 2 } \) H2 (g) + \(\frac { 1 }{ 2 } \) Br2 (l) → HBr (g)
ΔHr° = \(\frac { -{ 36.4{ { k }{ J } } } }{ M } \)
प्रत्येक मुक्त तत्व (C, S) की एन्थैल्पी 25°C ताप एवं 1 वायुमण्डलीय दाब पर शून्य मानी जाती है, जिससे यौगिक की एन्थैल्पी के मान उनकी मानक संभवन ऊष्माओं के समान हो जाते हैं।
C (s) + O2 (g) → CO2 (g)
ΔHf° = – 393.15 kJ
ΔHf° = CO2 की एन्थैल्पी – C की एन्थैल्पी + O2 की एन्थैल्पी
ΔHf° = उत्पादों की एन्थैल्पी – अभिकारकों की एन्थैल्पी
किसी यौगिक की एन्थैल्पी का ऋणात्मक मान से यह स्पष्ट होता है कि अभिक्रिया ऊष्माक्षेपी है एवं जिस यौगिक की एन्थैल्पी न्यूनतम (ऋणात्मक) होती है, वह यौगिक उतना ही अधिक स्थायी होता है एवं जिन यौगिकों की संभवन ऊष्मा का मान धनात्मक होता है, वे यौगिक ऊष्माशोषी कहलाते हैं एवं वे कम स्थायी होते हैं।
\(\frac { 1 }{ 2 } \) H2 (g) +\(\frac { 1 }{ 2 } \) I2 (g) → HI (g)
ΔHf° = + 26.49 kJ
H – I बन्ध, H – H एवं I – I बन्ध की तुलना में दुर्बल बन्ध होते है।
कुछ पदार्थों की मानक मोलर विरचन एन्थैल्पी (ΔHf°) नीचे सारणी में दी गई है –
सारणी – कुछ पदार्थों की मानक मोलर विरचन
एन्थैल्पी या संभवन ऊष्मा पदार्थ
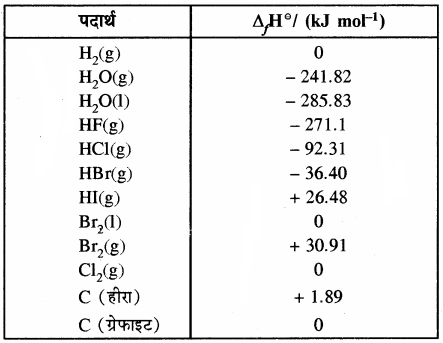
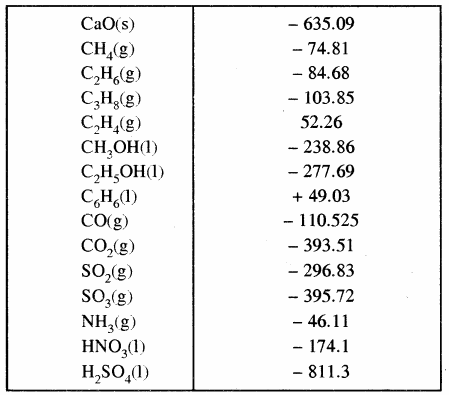
उदाहरण –
कैल्सियम कार्बोनेट की विघटन अभिक्रिया की एन्थैल्पी की गणना करना
CaCO3(s) → CaO(s) +CO2(g)
ΔrH⊝ = ?
यहाँ सभी पदार्थ मानक अवस्था में हैं अतः उनकी मानक विरचन एन्थैल्पी का प्रयोग करके उपरोक्त अभिक्रिया के एन्थैल्पी परिवर्तन की गणना करने के लिए निम्नलिखित सामान्य समीकरण का प्रयोग किया जा सकता है –
![]()
यहाँ संतुलित समीकरण में a एवं b क्रमशः अभिकारकों तथा उत्पादों के गुणांक हैं।
अतः CaCO3 के विघटन के लिए
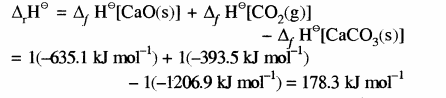
अतः CaCO3 का विघटन एक ऊष्माशोषी अभिक्रिया है अतः इसके लिए CaCO3 को गर्म करना पड़ता है।
2. प्रावस्था परिवर्तन एन्थैल्पी:
किसी गैसीय सहसंयोजक द्विपरमाणुक अणु के एक मोल में उपस्थित सभी बन्धों के टूटकर गैसीय उत्पाद बनने में हुए एन्थैल्पी परिवर्तन को आबन्ध वियोजन एन्थैल्पी या बन्ध वियोजन ऊर्जा कहते हैं।
H3 (g) → 2H (g)
ΔHb° = 435.0 kJ/m
उपरोक्त अभिक्रिया में एक मोल हाइड्रोजन में उपस्थित सभी आबंध टूटते हैं एवं इस प्रकार बंध वियोजन में 435.0 kJ एन्थैल्पी परिवर्तन होता है। यह डाइ हाइड्रोजन की कणन एन्थैल्पी के समान है। सभी द्विपरमाणुक अणुओं के लिए बंध वियोजन में एन्थैल्पी परिवर्तन उसकी कणन एन्थैल्पी के समान ही होती है।
Cl3 (g) → 2Cl (g)
ΔHb° = 242 kJ/m
O3 (g) → 2O (g)
ΔHb° = 428 kJ/m
बहुपरमाणुक अणु:
बहुपरमाणुक अणुओं में एक ही प्रकार के सभी बन्धों की बन्ध ऊर्जा भिन्न – भिन्न होती है, अतः औसत बन्ध ऊर्जा ली जाती है। जैसे CH4 में चारों C – H बन्ध समान हैं तथा इनकी बन्ध ऊर्जा भी समान है। लेकिन प्रत्येक C – H बन्ध को तोड़ने के लिए आवश्यक ऊर्जा भिन्नभिन्न होती है अतः औसत बन्ध ऊर्जा ली जाती है।
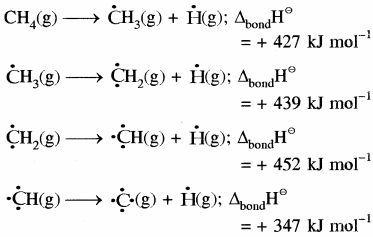
तथा
CH4 (g) → C (g) +4H (g);
ΔaH⊝ = 1665 kJ mol-1
अतः CH4 में C – H बंध की औसत बन्ध ऊर्जा (ΔC – HH⊝)
= \(\frac { 1 }{ 4 } \) (ΔaH⊝) CH4 = (1665 kJ mol-1)
= 416.25 kJ mol-1
इसी प्रकार H2O (g) → H (g) + OH (g);
ΔbondH⊝ = 497.8 kJ
तथा OH (g) → H (g) + O (g);
ΔbondH⊝ = 428.5 kJ
अतः औसत बन्ध ऊर्जा = \(\frac { 497.8+{ 428.5 } }{ 2 } \) = 463.2kJ
विभिन्न यौगिकों जैसे CH3 – CH2Cl – CH3 – CH2 – NO2
इत्यादि में C – H बन्ध की औसत बन्ध ऊर्जा एक – दूसरे से थोड़ी भिन्न होती है।
आबन्ध एन्थैल्पी:
किसी अभिक्रिया में आबंधों के टूटने व बनने में होने वाला ऊर्जा परिवर्तन होता है। यदि हमें किसी अभिक्रिया के विभिन्न आबंध एन्थैल्पी ज्ञात हैं तो गैसीय अवस्था में उस अभिक्रिया की एन्थैल्पी ज्ञात कर सकते हैं।
ΔH° = Σ = अभिकारकों की आबंध एन्थैल्पी – Σ उत्पादों की आबंध एन्थैल्पी
किसी अभिक्रिया की कुल अभिक्रिया एन्थैल्पी, उस अभिक्रिया में अभिकारक अणुओं के सभी आबंधों के वियोजन के लिये आवश्यक ऊर्जा एवं उत्पाद अणुओं के सभी आबंधों के बनने के लिये आवश्यक ऊर्जा का अन्तर होता है। बन्ध ऊर्जा को k.Cal mol-1 या kJ mol-1 में व्यक्त किया जाता है। नीचे दी गयी सारणी में एकल तथा बहुआबन्धों की बन्ध एन्थैल्पी के मान दिए गए हैं।
सारणी – कुछ एकल बन्धों के बन्ध एन्थैल्पी मान
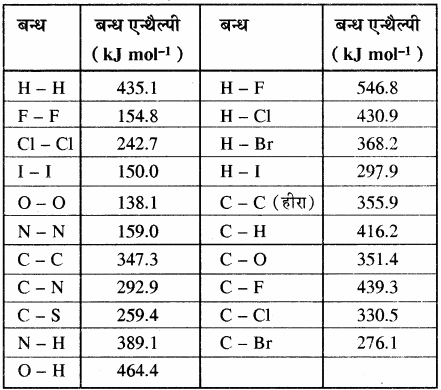
सारणी – कुछ बहुआबन्धों के बन्ध एन्थैल्पी मान
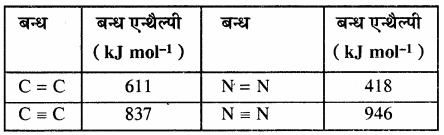
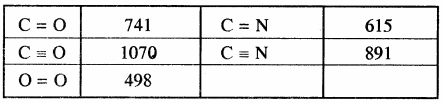
3. एन्ट्रॉपी:
सभी स्वतः प्रवर्तित प्रक्रमों के सम्पन्न होने पर निकाय की अव्यवस्था में वृद्धि होती है।
उदाहरण –
- जब किसी धातु के एक सिरे को गर्म करते हैं तो ऊष्मा के प्रवाह के पहले धातु का एक सिरा गर्म एवं दूसरा सिरा ठण्डा होता है। उस समय कुछ मात्रा में व्यवस्था होती है अर्थात् एक सिरे पर गर्म अणु तो दूसरे सिरे पर ठण्डे अणु रहते हैं। परन्तु जैसे ही गर्म से ठण्डे सिरे की तरफ ऊष्मा का प्रवाह होता है तो इलेक्ट्रॉन गति करने लगते हैं एवं अव्यवस्था में वृद्धि होती है।
- अधिक सान्द्रता वाले विलयन के अणुओं का कम सान्द्रता वाले विलयन की ओर विसरण होने पर निकाय की अव्यवस्था बढ़ जाती है।
- किसी ठोस पदार्थ के पिघलने पर एवं द्रव पदार्थ के वाष्पीकरण से निकाय की अव्यवस्था बढ़ने के कारण एन्ट्रॉपी में वृद्धि हो जाती है। ठोस पदार्थों में एक निश्चित क्रिस्टल जालक होने के कारण उनके अणुओं की एक निश्चित व्यवस्था होती है। अतः उनकी एन्ट्रॉपी कम होती है। परन्तु द्रव एवं गैस पदार्थों में उनके अणुओं में अव्यवस्था उत्पन्न हो जाती है, अतः उनकी एन्ट्रॉपी में वृद्धि हो जाती है अर्थात् किसी निकाय की एन्ट्रॉपी उसकी अव्यवस्था का माप होती है।
ठोस < द्रव < गैस (एन्ट्रॉपी) - अणुओं की संख्या या सान्द्रता बढ़ने के साथ – साथ एन्ट्रॉपी में वृद्धि होती है।
- ताप बढ़ाने पर अणुओं के ऊर्जा स्तर बढ़ने के साथ – साथ एन्ट्रॉपी में वृद्धि होती जाती है।
- जब किसी पदार्थ को किसी विलायक में घोला जाता है तो उसकी एन्ट्रॉपी में वृद्धि होती है क्योंकि पदार्थ के कण अव्यवस्थित हो जाते हैं।
- विभिन्न गैसों को मिश्रित करने पर एन्ट्रॉपी बढ़ती है।
किसी रासायनिक अभिक्रिया में गैसीय उत्पादों की संख्या बढ़ने पर एन्ट्रॉपी बढ़ेगी, लेकिन इसके विपरीत होने पर एन्ट्रॉपी कम होगी।
(NH4)2S (s) → 2NH3 (g) + H2S (g) (एन्ट्रॉपी में वृद्धि)
NH3 (g) + HCl (g) → NH4Cl (s) एन्ट्रॉपी में कमी - अण्डे को उबालने पर एन्ट्रॉपी में वृद्धि होती है, क्योंकि इससे अण्डे में उपस्थित प्रोटीन की संरचना में विकृति आ जाती है।
- रबर को खींचने पर एन्ट्रॉपी कम हो जाती है, क्योंकि इसमें उपस्थित ‘बहुलक श्रृंखलाएँ व्यवस्थित हो जाती हैं।
एन्ट्रॉपी से सम्बन्धित महत्त्वपूर्ण तथ्य –
- एन्ट्रॉपी एक मात्रात्मक गुण है।
- एक मोल पदार्थ की एन्ट्रॉपी को मोलर एन्ट्रॉपी कहते हैं।
- 298 K ताप तथा एक वायुमण्डलीय दाब पर एक मोल शुद्ध पदार्थ की एन्ट्रॉपी को मानक मोलर एन्ट्रॉपी (S°) कहते हैं।
- एन्ट्रॉपी को Cal. Degree-1 या JK-1 में तथा मोलर एन्ट्रॉपी को Cal. Degree-1 mol-1 या JK-1 mol-1 में व्यक्त किया जाता है।
- किसी अभिक्रिया के लिए एन्ट्रॉपी में परिवर्तन (ΔS) = उत्पादों की कुल एन्ट्रॉपी – अभिकारकों की कुल एन्ट्रॉपी
- किसी उत्क्रमणीय अभिक्रिया में साम्यावस्था पर एन्ट्रॉपी अधिकतम होती है लेकिन एन्ट्रॉपी में परिवर्तन (ΔS) = 0 होता है।
- स्वत:प्रवर्तित प्रक्रमों में एन्ट्रॉपी परिवर्तन हमेशा धनात्मक होता है अर्थात् इन प्रक्रमों में एन्ट्रॉपी बढ़ती है।
ΔS कुल > 0 अर्थात् ΔS निकाय + ΔS परिवेश > 0 - निकाय द्वारा ऊष्मा का अवशोषण करने पर ΔS का मान बढ़ता है। (ΔS = + ve) तथा निकाय द्वारा ऊष्मा का उत्सर्जन करने पर ΔS का मान कम होता है (ΔS = – ve).
- रुद्धोष्म उत्क्रमणीय प्रक्रम में qrev = 0 होने के कारण एन्ट्रॉपी परिवर्तन भी शून्य होता है (ΔS = 0)
4. विलायकन एन्थैल्पी:
जब किसी विलेय (Solute) के एक मोल को विलायक की निश्चित मात्रा में घोलने पर एन्थैल्पी में होने वाले परिवर्तन को उस पदार्थ की विलायकन एन्थैल्पी कहते हैं। जब किसी पदार्थ को विलायक की अनन्त मात्रा में घोलते हैं, तब विलेय के अणुओं के मध्य क्रिया नगण्य होती है। इस प्रकार का एन्थैल्पी परिवर्तन जो अत्यन्त तनुता पर होता है, उसे विलयन एन्थैल्पी कहते हैं।
जब किसी आयनिक यौगिक को किसी विलायक में घोलते हैं तो उसके आयनन के लिए आवश्यक एन्थैल्पी को जालक (Lattice) एन्थैल्पी कहते हैं। क्रिस्टल जालक में आयन अपनी नियमित स्थिति छोड़ देते हैं एवं विलयन में अधिक स्वतंत्र रहते हैं। यदि विलायक के रूप में जल लेते हैं तो इन आयनों का जलयोजन होता है अर्थात् आयनिक यौगिक के घुलने में इन दोनों एन्थैल्पी का योगदान होता है। किसी आयनिक यौगिक [AB(s)] को जल में घोलने पर हुए विभिन्न परिवर्तनों को निम्न प्रकार दर्शाया जा सकता है –
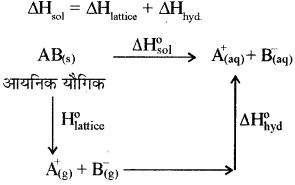
एक मोल निर्जल पदार्थ के पूर्व जलयोजन पर उत्सर्जित ऊष्मा को जलयोजन एन्थैल्पी कहते हैं।
उदाहरण –
BaCl2 + 2H2O (l) → BaCl2.2H2O (s)
ΔH°hyd = – 29.4 kJ/m
ZnSO4 (s) + 5H2O (l) → ZnSO4.5H2O
ΔH° = – 30.0 kJ
सामान्यतया आयनिक यौगिकों के लिये H का मान धनात्मक होता है। अतः अधिकांश यौगिकों की जल में विलेयता ताप बढ़ाने पर बढ़ती है। परन्तु यदि जालक एन्थैल्पी बहुत अधिक है तो वह यौगिक जल में विलेय नहीं होगा। इसी कारण अधिकतर फ्लोराइड, क्लोराइडों की अपेक्षा कम विलेय होते हैं। किसी सान्द्रता का विलयन बनाने के लिये एक मोल विलेय को शुद्ध विलायक में घोलने पर एन्थैल्पी में परिवर्तन को समाकल विलयन ऊष्मा कहते हैं।
KCl (s) + 200 H2O (l) → KCl (200 H2O)
ΔHsol = + 18.58 kJ
अर्थात् 1 मोल KCl को जल के 200 मोलों में घोलने पर 18.58 kJ ऊष्मा अवशोषित होती है।
RBSE Class 11 Chemistry Chapter 6 आंकिक प्रश्न
प्रश्न 40.
अभिक्रिया X – Y के लिए 298 k ताप पर मानक एन्ट्रॉपी क्या होगी? जब साम्यावस्था स्थिरांक 1.8 × 10-7 है।
हल –
हम जानते हैं –

प्रश्न 41.
60°C ताप पर डाइ नाइट्रोजन टेट्राक्साइड 50 प्रतिशत वियोजित होता है। एक वायुमण्डलीय दाब और इस ताप पर मानक मुक्त ऊर्जा परिवर्तन की गणना कीजिए।
हल –
N2O4 (g) = 2NO2 (g) एक mole W2O4 दो मोल NO2 देता है।

प्रश्न 42.
एक गैस का STP पर आयतन 2 लीटर है। इसको 300 जूल ऊष्मा दी जाती है, जिससे गैस का आयतन एक वायुमण्डल दाब पर 2.5 लीटर हो जाता है। गैस की आन्तरिक ऊर्जा में हुए परिवर्तन की गणना कीजिए।
हल –
P = 1 atm
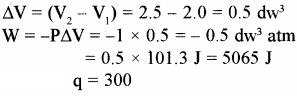
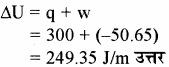
प्रश्न 43.
0°C और 1 वायुमण्डलीय दाब पर जब 1 मोल बर्फ पिघलती है तो निकाय के द्वारा 6.05 kJ mol-1 ऊष्मा अवशोषित होती है। बर्फ एवं जल के मोलर आयतन क्रमशः 0.0196 और 0.0180 लीटर है। ΔH और ΔU की गणना कीजिये।
हल –

प्रश्न 44.
जब 1 मोल H2O (l) को मानक परिस्थितियों में विरचित किया जाता है तब परिवेश में एन्ट्रॉपी परिवर्तन की गणना कीजिए।
हल –
ΔfH° = – 286 kJ mol-1
ΔfH° (H2O) = – 286.0 kJ mol-1
अर्थात् परिवेश को ऊष्मा दी जा रही है अर्थात् अभिक्रिया से ऊष्मा उत्सर्जित हो रही है।
मानक परिस्थिति में T = 298 k

प्रश्न 45.
एक बम कैलोरीमीटर में NH2CN (s) की अभिक्रिया डाइ ऑक्सीजन के साथ की गई एवं ΔU का मान – 742.7 kJ mol-1 पाया गया। निम्न अभिक्रिया के लिए 298K पर एन्थैल्पी परिवर्तन ज्ञात कीजिए।
NH2CN(s) + \(\frac { 3 }{ 2 } \) O2 (g) → N (g) + CO2 (g) + H2O (l)
हल –
ΔU = – 742.7 kJ mol-1
R = 8.314 × 10-3 kJ k-1 mol-1
T = 298 K
Δn (g) = 2 – \(\frac { 3 }{ 2 } \) = 0.5
ΔH = ΔU+Δn (g) + RT
ΔH = – 742.7 kJ + 0.5 mol × 8.314 × 10-3 (kJ k-1 mol-1) × 298 K
ΔH =- 7427 + 1.2387
ΔH = – 742.7 + 1.239
ΔH = – 741.5 kJ = – 741.46 उत्तर
प्रश्न 46.
60 gm एल्युमिनियम का ताप 36°C से 55°C करने के लिए कितने किलो जूल ऊष्मा की आवश्यकता होगी? Al की मोलर ऊष्माधारिता 27 J molk-1 है।
हल –

(Al का परमाणु द्रव्यमान = 27)
Al की मोलर ऊष्माधारिता (Cm) = 24.0 J mol-1 k-1
ΔT = 55 – 35 = 20° या 20 k
अतः q = Cm × n × ΔT
= 24.0 (J mol-1 k-1) × 2.22 (mol) × 20 (k)
q = 1065.6 J = 1.0656 kJ
q = 1.066 kJ उत्तर
प्रश्न 47.
10°C पर 1 मोल जल की बर्फ – 10°C पर जमाने पर एन्थैल्पी परिवर्तन की गणना कीजिए।


प्रश्न 48.
CO (g), CO2 (g), N2O (g) एवं N2O4 (g) की विरचन एन्थैल्पी क्रमशः – 110, – 393, 81 तथा 9.8 kJ mol-1 है।
अभिक्रिया –
N2O4 (g) + 3 CO (g) → N2O (g) +3 CO2 (g) के लिए ΔHf का मान ज्ञात कीजिये।
हल –

प्रश्न 49.
अभिक्रिया 2A (g) + B (g) → 2D (g) के लिए ΔU° = – 10.5 kJ, ΔS° = – 44.1 JK-1 अभिक्रिया के लिए ΔG° की गणना कीजिये। क्या यह अभिक्रिया स्वतः प्रवर्तित होगी?
हल –
ΔH° = ΔU° + ΔH (g) RT
ΔU° = – 10.5 kJ; T = 298 K (मानक परिस्थिति)
ΔH (g) = 2 – 3 = – 1 mol
R = 8.314 × 10-3 kJ k-1 mol-1
अत:
ΔH° = – 10.5 (kJ) + (- 1) mol × 8.314 × 10-3 (kJ k-1 mol-1) × 298 k
ΔH° = – 12.978 kJ
गिब्स – हेल्महोल्ट्ज समीकरण के अनुसार
ΔG° = ΔH – TΔS° (ΔS = 44.1 kJ k-1)
ΔG° = – 12.978 (kJ) – (298 (k) × – 44.1 × 10-3) (kJ k-1)
ΔG° = – 12.978 + 13.141
ΔG° = 0.163 kJ
चूंकि ΔG° धनात्मक है अतः अभिक्रिया स्वतः प्रवर्तित नहीं होगी।