RBSE Solutions for Class 9 Science Chapter 4 रासायनिक बंध व रासायनिक समीकरण are part of RBSE Solutions for Class 9 Science. Here we have given Rajasthan Board RBSE Class 9 Science Chapter 4 रासायनिक बंध व रासायनिक समीकरण
| Board | RBSE |
| Textbook | SIERT, Rajasthan |
| Class | Class 9 |
| Subject | Science |
| Chapter | Chapter 4 |
| Chapter Name | रासायनिक बंध व रासायनिक समीकरण |
| Number of Questions Solved | 78 |
| Category | RBSE Solutions |
Rajasthan Board RBSE Class 9 Science Chapter 4 रासायनिक बंध व रासायनिक समीकरण
पाठ्य-पुस्तक के प्रश्न एवं उनके उत्तर
वस्तुनिष्ठ प्रश्न
प्रश्न 1.
सोडियम का प्रतीक है
(अ) s
(ब) si
(स) Na
(द) Ni.
उत्तर:
(स) Na
प्रश्न 2.
काबनिट मूलक का सूत्र है
(अ) CO2
(ब) \(\mathrm { CO } _ { 3 } ^ { 2 – }\)
(स) \(\mathrm { CO } _ { 3 } ^ { 1 – }\)
(द) CO.
उत्तर:
(ब) \(\mathrm { CO } _ { 3 } ^ { 2 – }\)
प्रश्न 3.
सोडियम क्लोराइड में उपस्थित बन्ध का नाम है
(अ) आयनिक बन्ध
(ब) सह-संयोजक बन्ध
(स) धात्विक बन्ध
(द) हाइड्रोजन बन्ध।
उत्तर:
(अ) आयनिक बन्ध
प्रश्न 4.
निम्नलिखित में से परिवर्तनशील संयोजकता प्रदर्शित करने वाला तत्व है
(अ) Na
(ब) Ca
(स) K
(द) Cu.
उत्तर:
(द) Cu.
प्रश्न 5.
कैल्शियम ऑक्साइड का सूत्र है
(अ) Ca2O2
(ब) CaO2
(स) CaO
(द) CaO3.
उत्तर:
(स) CaO
प्रश्न 6,
तत्वों की आधुनिक प्रतीक प्रणाली के जन्मदाता थे
(अ) बर्जीलियस
(ब) जॉन डाल्टन
(स) रदरफोर्ड
(द) नील्स बोर।
उत्तर:
(अ) बर्जीलियस
प्रश्न 7.
निम्नलिखित में से सह-संयोजक बन्य युक्त अणु है
(अ) H2O
(ब) NaCl
(स) CaO
(द) CaCO3.
उत्तर:
(अ) H2O
प्रश्न 8.
Fe निम्नलिखित में से किसका प्रतीक है
(अ) लोहे का
(ब) ताँबे का
(स) सोने का
(द) चाँदी का।
उत्तर:
(अ) लोहे का
अति लघूत्तरात्मक प्रश्न
प्रश्न 9.
मूलक किसे कहते हैं ?
उत्तर:
आयनिक पदार्थ, अम्ल व क्षारक जल में विलेय होकर आयनों में अपघटित हो जाते हैं, जो अभिक्रिया में एक इकाई की तरह भाग लेते हैं, इन्हें मूलक कहते हैं।
प्रश्न 10.
आयनिक बन्ध को परिभाषित करिए।
उत्तर:
परमाणुओं के मध्य इलेक्ट्रॉनों के स्थानान्तरण से जो बन्ध बनता है, उसे आयनिक बन्ध कहते हैं।
प्रश्न 11.
पोटैशियम का प्रतीक व लेटिन नाम लिखिए।
उत्तर:
पोटैशियम-प्रतीक-k
लेटिन नाम -Kallium
प्रश्न 12.
अणुसूत्र की परिभाषा लिखिए।
उत्तर:
तत्वों के प्रतीकों का वह संयोजन जो किसी तत्व या यौगिक के एक अणु को प्रदर्शित करता है, अणुसूत्र कहलाता है।
प्रश्न 13.
कैल्शियम कार्बोनेट का सूत्र लिखिए।
उत्तर:
कैल्शियम कार्बोनेट
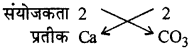
प्रश्न 14.
एक त्रिसंयोजी अम्लीय मूलक का सूत्र लिखिए।
उत्तर:
त्रिसंयोजी अम्लीय मूलक- \(\mathrm { PO } _ { 4 } ^ { 3 – }\) (फॉस्फेट)।
प्रश्न 15.
ऋणायन किसे कहते हैं ?
उत्तर:
तत्व के विलगित गैसीय परमाणु के बाह्यतम कोश में एक या अधिक इलेक्ट्रॉन जुड़ने से बने ऋण आवेशित कण को ऋणायन कहते हैं।
उदाहरणार्थ–
\(\mathrm { Cl } _ { ( g ) } + e ^ { – } \longrightarrow \mathrm { Cl } ^ { – } ( g ) +\) + ऊर्जा
प्रश्न 16.
संयोजकता किसे कहते हैं ?
उत्तर:
परमाणु अपने बाह्यतम कोश में अष्टक पूरा करने के लिए जितने इलेक्ट्रॉन साझा या स्थानान्तरण करता है, वही तत्व की संयोजन क्षमता या संयोजकता कहलाती है।
लघूत्तरात्मक प्रश्न
प्रश्न 17.
धनायन का आकार अपने संगत परमाणु से छोटा होता है ? समझाइए।
उत्तर:
धनायन का आकार अपने संगत परमाणु से सदैव छोटा होता है क्योंकि बाह्यतम कोश के इलेक्ट्रॉन हटने से नाभिक और इलेक्ट्रॉन के मध्य आकर्षण बल बढ़ जाने से आकार घट जाता है।
प्रश्न 18.
परिवर्तनशील संयोजकता को उदाहरण सहित समझाइए।
उत्तर:
कुछ तत्वों की संयोजकता निश्चित न होकर एक से अधिक होती है। इसे परिवर्तनशील संयोजकता कहते हैं, जैसे-Fe की संयोजकता 2 व 3 होती है क्योंकि यह FeSO4 यौगिक बनाकर 2 संयोजकता प्रदर्शित करता है। वहीं FeCl3 यौगिक में 3 संयोजकता दर्शाता है।
प्रश्न 19.
उपसह-संयोजक बन्ध किसे कहते हैं ? एक उदाहरण दीजिए।
उत्तर:
वे सह-संयोजक बन्ध जिनः बन्ध इलेक्ट्रॉन (-युग्म के दोनों इलेक्ट्रॉन) एक ही परमाणु द्वारा दिये जाते हैं, परन्तु साझेदारी दोनों परमाणुओं के मध्य होती है, उपसह-संयोजक बन्ध कहलाते हैं, जैसे-ओजोन अणु का निर्माण।
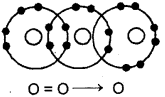
प्रश्न 20.
आयनन ऊर्जा को समझाइए।
उत्तर:
धन विद्युती तत्व सोडियम का इलेक्ट्रॉनिक विन्यास 2, 8, 1 होता है, इसके बाह्यतम कोश में एक इलेक्ट्रॉन होता है, जिसे ऊर्जा प्रदान कर आसानी से हटाया जा सकता है, यह ऊर्जा आयनन एन्थैल्पी कहलाती हैं। अर्थात् किसी परमाणु के बाह्यतम कोश से एक इलेक्ट्रॉन को हटाने के लिये आवश्यक ऊर्जा आयनन एन्थैल्पी कहलाती है।
\(\mathrm { Na } _ { ( g ) }\) + आयनन एन्थैल्पी → \(\mathrm { Na } ^ { + } _ { ( g ) } + e ^ { – }\)
प्रश्न 21.
द्वि-बन्ध व त्रि-बन्ध को उदाहरण सहित समझाइए।
उत्तर:
द्वि-बन्ध-जब दो परमाणुओं के मध्य दो इलेक्ट्रॉनों का साझा होता है, तो उनके मध्य बनने वाला बन्ध द्वि-बन्ध होता है।
उदाहरण- O2
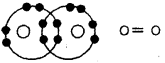
त्रि-बन्ध-जब दो परमाणुओं के मध्य तीन-तीन इलेक्ट्रॉनों का साझा होता है, तो उनके मध्य बनने वाला बन्ध त्रि-बन्ध होता है।
उदाहरण-नाइट्रोजन अणु ।
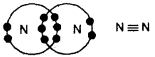
निबन्धात्मक प्रश्न
प्रश्न 22.
सह-संयोजक व आयनिक यौगिकों में अन्तर स्पष्ट कीजिए।
उत्तर:
अन्तर
| आयनिक यौगिक | सह-संयोजक यौगिक |
| 1. आयनिक यौगिक प्रायः ठोस होते हैं। | 1. ये ठोस, द्रव एवं गैस तीनों ही हो सकते हैं। |
| 2. यह आयनों से मिलकर बना होता है। | 2. यह अणुओं से मिलकर बना होता है। |
| 3. आयनिक बन्ध दिशात्मक नहीं होते हैं। | 3. सह संयोजक बन्ध में दिशात्मक गुण पाये। जाते हैं। |
| 4. आयनिक यौगिक कठोर एवं भंगुर प्रकृति के होते | 4. ये अपेक्षाकृत कमजोर, मृदु एवं गलनीय होते |
| 5. इनके गलनांक एवं क्वथनांक उच्च होते हैं। | 5. इनके गलनांक व। क्वथनांक निम्न होते हैं। |
| 6. ये ध्रुवीय विलायकों में | विलेय होते हैं। | 6. ये अध्रुवीय विलायकों में विलेय होते हैं। |
| 7. इनकी अभिक्रियाएँ तीव्र गति से होती हैं। | 7. इनकी अभिक्रियाएँ मन्द गति से होती हैं। |
प्रश्न 23.
निम्नलिखित के अणुसूत्र लिखिए
1. सोडियम कार्बोनेट,
2. जिंक सल्फाइड,
3. ऐल्युमीनियम ऑक्साइड,
4. फेरक सल्फेट,
5. बेरियम क्लोराइड,
6. मैग्नीशियम कार्बोनेट।
उत्तर:
- सोडियम कार्बोनेट
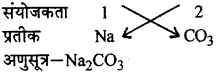
- जिंक सल्फाइड
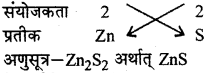
- ऐल्युमीनियम ऑक्साइड
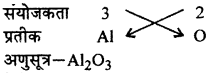
- फेरिक सल्फेट
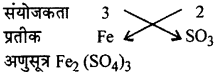
- बेरीयम क्लोराइड
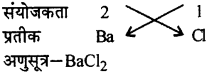
- मैग्नीशियम कार्बोनेट
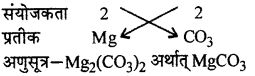
प्रश्न 24.
समीकरण सन्तुलित कीजिए
(i) \(\quad \mathrm { KClO } _ { 3 } \longrightarrow \mathrm { KCl } + \mathrm { O } _ { 2 }\)
(ii) \(\mathrm { BaCl } _ { 2 } + \mathrm { AgNO } _ { 3 } \longrightarrow \mathrm { AgCl } + \mathrm { Ba } \left( \mathrm { NO } _ { 3 } \right) _ { 2 }\)
(iii) \(\quad \mathrm { Mg } + ^ { \cdot } \mathrm { HCl } \longrightarrow \mathrm { MgCl } _ { 2 } + \mathrm { H } _ { 2 }\)
(iv) \(\quad \mathrm { NaOH } + \mathrm { Cl } _ { 2 } \longrightarrow \mathrm { NaCl } + \mathrm { NaOCl } + \mathrm { H } _ { 2 } \mathrm { O }\)
उत्तर:
\(( \mathrm { i } ) \quad 2 \mathrm { KClO } _ { 3 } \longrightarrow 2 \mathrm { KCl } + 3 \mathrm { O } _ { 2 }\)
\(\begin{array} { l } { \text { (ii) } \mathrm { BaCl } _ { 2 } + 2 \mathrm { AgNO } _ { 3 } \longrightarrow 2 \mathrm { AgCl } + \mathrm { Ba } \left( \mathrm { NO } _ { 3 } \right) _ { 2 } } \\ { \text { (iii) } \mathrm { Mg } + 2 \mathrm { HCl } \longrightarrow \mathrm { MgCl } _ { 2 } + \mathrm { H } _ { 2 } } \\ { \text { (iv) } 2 \mathrm { NaOH } + \mathrm { Cl } _ { 2 } \longrightarrow \mathrm { NaCl } + \mathrm { NaOCl } + \mathrm { H } _ { 2 } \mathrm { O } } \end{array}\)
अन्य महत्वपूर्ण प्रश्न एवं उनके उत्तर
वस्तुनिष्ठ प्रश्न
प्रश्न 1.
निम्न में से किसमें आयनिक बन्ध है
(अ) CHCl3
(ब) O2
(स) BaCl2
(द) CClu4.
उत्तर:
(स) BaCl2
प्रश्न 2.
द्रवित सोडियम क्लोराइड विद्युत धारा का प्रवाह कर सकता है क्योंकि इसमें उपस्थित होता है
(अ) मुक्त इलेक्ट्रॉन
(ब) मुक्त आयन
(स) मुक्त अणु
(द) सोडियम तथा क्लोरीन के परमाणु
उत्तर:
(ब) मुक्त आयन
प्रश्न 3.
निम्न में से कौन परिवर्तित संयोजकता प्रदर्शित करता
(अ) H
(ब) Na
(स) Fe
(द) O.
उत्तर:
(स) Fe
प्रश्न 4.
एक ठोस x विद्युत् का कुचालक है जो जल में डालने पर सुचालक हो जाता है, वह होगा
(अ) धात्विक ठोस
(ब) आयनिक ठोस
(स) उपसहसंयोजक ठोस
(द) उपरोक्त सभी।
उत्तर:
(ब) आयनिक ठोस
प्रश्न 5.
अर्जेन्टम किस तत्व का लेटिन नाम है
(अ) Au
(ब) Al
(स) Ag
(द) Na.
उत्तर:
(स) Ag
प्रश्न 6.
अन-निल-ट्राइयम का प्रतीक है
(अ) Unt
(ब) Unb
(स) Unn
(द) Unq.
उत्तर:
(अ) Unt
प्रश्न 7.
अन-निल-क्वाडियम का परमाणु क्रमांक है
(अ) 101
(ब) 103
(स) 104
(द) 109.
उत्तर:
(स) 104
प्रश्न 8.
किसी विलगित गैसीय परमाणु से इलेक्ट्रॉन को निकालने के लिये आवश्यक ऊर्जा को कहते हैं
(अ) इलेक्ट्रॉनलब्धि ऊर्जा
(ब) आयनन ऊर्जा
(स) (अ) व (ब) दोनों
(द) उपरोक्त कोई नहीं।
उत्तर:
(ब) आयनन ऊर्जा
प्रश्न 9.
किसी विलगित गैसीय परमाणु के बाह्यतम कोश में एक इलेक्ट्रॉन को जोड़ने पर निर्मुक्त ऊर्जा कहलाती है
(अ) आयनन एन्थैल्पी
(ब) इलेक्ट्रॉन लब्धि एन्थैल्पी
(स) (अ) व (ब) दोनों
(द) उपरोक्त में से कोई नहीं।
उत्तर:
(ब) इलेक्ट्रॉन लब्धि एन्थैल्पी
प्रश्न 10.
सरल मूलक का उदाहरण है
(अ) Na+
(ब) Mg2+
(स) Cl–
(द) उपरोक्त सभी।
उत्तर:
(द) उपरोक्त सभी।
प्रश्न 11.
फॉस्फाइड मूलक का सूत्र है
(अ) \(\mathrm { PO } _ { 4 } ^ { 3 – }\)
(ब) P3-
(स) P2-
(द) P–.
उत्तर:
(ब) p3-
प्रश्न 12.
अष्टक नियम दिया था
(अ) बर्जीलियस ने
(ब) डॉल्टन ने
(स) कॉसेल-लुईस ने
(द) नागार्जुन ने।
उत्तर:
(स) कॉसेल-लुईस ने
प्रश्न 13.
अमोनियम कार्बोनेट का सूत्र है
(अ) (NH4)CO3
(ब) NH4CO3
(स) NH4(CO3)2
(द) उपरोक्त में से कोई नहीं।
उत्तर:
(अ) (NH4)CO3
प्रश्न 14.
सोडियम क्लोराइड क्रिस्टल में एक क्लोराइड कितने सोडियम आयनों से घिरा होता है
(अ) 5
(ब) 6
(स) 4
(द) 3.
उत्तर:
(ब) 6
अति लघूत्तरात्मक प्रश्न
प्रश्न 1.
NaCl अथवा KCI विद्युत् संयोजी हैं। क्यों ?
उत्तर:
क्योंकि क्षार धातुओं (Na अथवा K) तथा CI की विद्युत ऋणात्मकता में आयनिक बन्ध बनने के लिये पर्याप्त अन्तर होता है।
प्रश्न 2.
ठोस Nacl विद्युत का कुचालक क्यों है ?
उत्तर:
ठोस NaCl में Na(ब) p+ तथा Cl(ब) p– गतिमान नहीं हो पाते हैं। जिससे इनमें विद्युत का प्रवाह नहीं हो पाता है।
प्रश्न 3.
आयनिक यौगिकों की अभिक्रियाएँ तीव्र क्यों होती हैं ?
उत्तर:
आयनिक यौगिकों का जल में शीघ्र आयनन हो जाने से इनकी अभिक्रियाएँ तीव्र (शीघ्र) हो जाती हैं।
प्रश्न 4.
आयनिक तथा सहसंयोजी यौगिकों में किसके गलनांक व क्वथनांक ऊँचे होते हैं।
उत्तर:
आयनिक यौगिकों के गलनांक व क्वथनांक उच्च होते हैं।
प्रश्न 5.
विद्युत संयोजी यौगिक अवाष्पशील क्रिस्टलीय ठोस होते हैं, क्यों ?
उत्तर:
क्योंकि विद्युत् संयोजी यौगिकों में आयनों के बीच शक्तिशाली विद्युत् संयोजी बल कार्य करता है जिससे ये वाष्पित नहीं हो पाते हैं।
प्रश्न 6.
BaCI2 विद्युत संयोजी यौगिक क्यों है ?
उत्तर:
Ba व Cl परमाणु की विद्युत ऋणात्मकता में अधिक अन्तर होने के कारण BaCl2, विद्युत संयोजी यौगिक है।
प्रश्न 7.
सूखी बर्फ (dry ice) क्या है? यह किस प्रकार का ठोस है?
उत्तर:
सूखी बर्फ CO2(g) को कहते हैं। यह एक आण्विक ठोस है।
प्रश्न 8.
निम्नलिखित यौगिकों के रासायनिक सूत्र लिखिए।
(i) सल्फ्यूरिक अम्ल
(ii) कैल्शियम हाइड्रॉक्साइड।
उत्तर:
सल्फ्यूरिक अम्ल \(\mathrm { H } _ { 2 } \mathrm { SO } _ { 4 }\)
कैल्शियम हाइड्रॉक्साइड \(\mathrm { Ca } ( \mathrm { OH } ) _ { 2 }\)
प्रश्न 9.
निम्नलिखित यौगिकों के नाम लिखिए। (NH4)2 SO4 तथा Na2S
उत्तर:
(NH4)2 SO4 अमोनियम सल्फेट
Na2S – सोडियम सल्फाइड
प्रश्न 10.
1. Ag2O तथा
2. Cus यौगिकों के नाम बताइये।
उत्तर:
- सिल्वर ऑक्साइड।
- कॉपर सल्फाइड।
प्रश्न 11,
CaCO3 का यौगिक नाम क्या है ?
उत्तर:
कैल्सियम कार्बोनेट।
प्रश्न 12.
CH3OH का आण्विक द्रव्यमान ज्ञात कीजिए।
उत्तर:
CH3OH का आण्विक द्रव्यमान,
=1 × 12 + 3 × 1 + 1 × 16 + 1 × ]
=12 + 3 + 16 + 1
=32 u.
प्रश्न 13.
आयन क्या है ?
उत्तर:
वह आवेशित कण जिस पर धन अथवा ऋण आवेश हो सकता है, आयन कहलाता है।
प्रश्न 14.
किसी आयनिक यौगिक का सूत्र ज्ञात करने में कौन सहायता करता है?
उत्तर:
आयनों पर उपस्थित आवेश।
प्रश्न 15.
धनायन किसे कहते हैं ?
उत्तर:
तत्व के विलगित गैसीय परमाणु के संयोजकता कोश में इलेक्ट्रॉन निकलने पर धनायन बनता है।
प्रश्न 16.
सरल मूलक किसे कहते हैं ?
उत्तर:
एक ही प्रकार के परमाणुओं से बने मूलक, सरल मूलक कहलाते हैं।
उदाहरण- \(\mathrm { Na } ^ { + } , \mathrm { Mg } ^ { 2 + } , \mathrm { Cl } ^ { – } , \mathrm { Br } ^ { – }\).
प्रश्न 17.
संयुक्त मूलक किसे कहते हैं ?
उत्तर:
दो या दो से अधिक परमाणुओं का समूह जिस पर कोई निश्चित आवेश होता है, उसे संयुक्त मूलक कहते हैं।
उदाहरण- \(\mathrm { NO } _ { 3 } ^ { – } , \mathrm { NH } _ { 3 } ^ { + }\) ई आदि।
प्रश्न 18.
अम्लीय मूलक किसे कहते हैं ?
उत्तर:
अधातु ऋणायन व ऋण आवेशित मूलकों को अम्लीय मूलक कहते हैं।
उदाहरण-
\(\mathrm { Cl } ^ { – } , \mathrm { Br } , \mathrm { NO } _ { 3 } ^ { – }\) आदि।
प्रश्न 19.
क्षारीय मूलक किसे कहते हैं ?
उत्तर:
ये धातु धनायन या धन आवेशित मूलक होते हैं। ये धात्विक भस्मों से प्राप्त होते हैं। अत: इन्हें भास्मिक मूलक भी कहते हैं।
प्रश्न 20,
नागार्जुन के द्वारा लिखे ग्रन्थ का क्या नाम है ?
उत्तर:
रसरत्नाकार।
लघु उत्तरय प्रश्न
प्रश्न 1.
परमाणु क्रमांक 107, 111 व 113 का नामकरण कीजिए।
उत्तर:
107 – अन-निल-सेप्टियम् (Uns)
111 – अन-अन-अनियम (Uuu)
113 – अन-अन-ट्राइयम(Uut)
प्रश्न 2.
Unb, Uun तथा Uus किन परमाणुओं के प्रतीक हैं ? बताइए। परमाणु क्रमांक भी लिखिए।
उत्तर:
Unb – 102 – अन-निल-बाइयम
Uun – 110 – अन-अन-निलम
Uus – 117 – अन-अन-सेप्टियम
प्रश्न 3.
इलेक्ट्रॉन लब्धि एन्थैल्पी समझाइए।
उत्तर:
तत्व के विलगित गैसीय परमाणु के बाहातम कोश में एक या अधिक इलेक्ट्रॉन जुड़ने से बने ऋण आवेशित कण को ऋणायन कहते हैं। इस क्रिया में प्रथम इलेक्ट्रॉन जुड़ने से ऊर्जा विमुक्त होती है, जिसे इलेक्ट्रॉन लब्धि एन्थैल्पी कहते
प्रश्न 4.
कॉसेल-लुईस के अष्टक नियम को लिखिए।
उत्तर:
कॉसेल-लुईस के अष्टक नियमानुसार, परमाणु के बाह्यतम कोश में अष्टक पूर्ण करने के लिये एक परमाणु से दूसरे परमाणु में इलेक्ट्रॉन का स्थानान्तरण अथवा सहभाजन होता है तथा दो परमाणु आपस में संयोजित हो जाते हैं।
प्रश्न 5.
रासायनिक बन्ध किसे कहते हैं ?
उत्तर:
किसी अणु के अवयवी कणों (आयन, परमाणु) के मध्य उपस्थित आकर्षण बल जो उन्हें एक साथ बाँधे रखता है रासायनिक बन्ध कहलाता है।
प्रश्न 6.
रासायनिक बन्ध में ऊर्जा का क्या योगदान है ?
उत्तर:
रासायनिक बन्ध बनने पर अणु की कुल ऊर्जा पृथक्-पृथक् परमाणुओं की कुल ऊर्जा से कम होती हैं। ऊर्जा में यह कमी अणु को परमाणु से अधिक स्थायी बनाती हैं अर्थात् ऊर्जा जितनी कम होगी, अणु उतना ही ज्यादा स्थायी होगा।
प्रश्न 7.
सह-संयोजक बन्ध को उदाहरण सहित समझाइए
उत्तर:
जब दो या दो से अधिक परमाणु संयुक्त होते हैं तो अष्टक प्राप्त करने के लिये बाह्यकक्ष के इलेक्ट्रॉन साझा कर इलेक्ट्रॉन युग्म बनाते हैं। इस प्रकार बने बन्ध को सहसंयोजक बन्ध कहते हैं।
उदाहरण – HCI
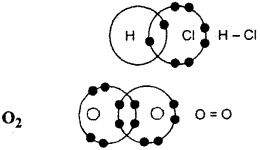
प्रश्न 8.
निम्न के सूत्र लिखिए
- सोडियम ऑक्साइड,
- एल्युमीनियम क्लोराइड,
- सोडियम सल्फाइड,
- मैग्नीशियम हाइड्रॉक्साइड।
उत्तर:
- सोडियम ऑक्साइड
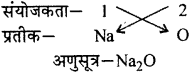
- एल्युमीनियम क्लोराइड
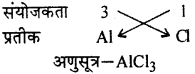
- सोडियम सल्फाइड
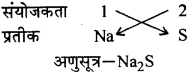
- मैग्नीशियम हाइड्रॉक्साइड
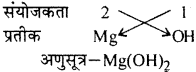
प्रश्न 9.
निम्नलिखित सूत्रों द्वारा प्रदर्शित यौगिकों के नाम लिखिए।
- Al2(SO4)3
- CaCl2
- K2SO4
- KNO3
- CaCO3.
उत्तर:
- एल्युमीनियम सल्फेट,
- कैल्शियम क्लोराइड,
- पोटैशियम सल्फेट,
- पोटैशियम नाइट्रेट,
- कैल्शियम कार्बोनेट।
प्रश्न 10.
निम्नलिखित के द्वारा बने यौगिकों के सूत्र तथा नाम बताइये
(i) \(\mathrm { Cu } ^ { 2 + }\) तथा \(\mathrm { O } ^ { 2 – }\)
(ii) \(\mathbf { K } ^ { + }\) तथा \(\mathrm { CO } _ { 3 } ^ { 2 – }\)
(iii) \(\mathbf { C u } ^ { 2 + }\) तथा \(\mathrm { SO } _ { 4 } ^ { 2 – }\)
(iv) \(\mathbf { N a } ^ { + }\) तथा \(\mathrm { HCO } _ { 3 } ^ { – }\)
उत्तर:
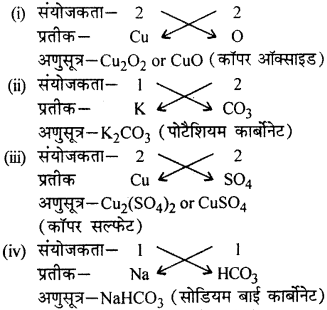
प्रश्न 11.
निम्नलिखित के द्वारा बने यौगिकों के सूत्र तथा नाम लिखिए
(i) \(\mathrm { Fe } ^ { 3 + }\) तथा \(\mathrm { SO } _ { 4 } ^ { 2 – }\)
(ii) \(\mathrm { Cr } ^ { 3 + }\) तथा \(\mathrm { PO } _ { 4 } ^ { 3 – }\)
(iii) \(\mathbf { Z n } ^ { 2 + }\) तथा \(\mathrm { SO } _ { 4 } ^ { 2 – }\)
(iv) \(\mathrm { Na } ^ { + }\) तथा \(\mathrm { SO } _ { 4 } ^ { 2 – }\)
(v) \(\mathrm { Hg } _ { 2 } ^ { 2 + }\) तथा \(\mathrm { Cr }\)
(vi) \(\mathbf { N H } _ { 4 } ^ { + }\) तथा \(\mathrm { co } _ { 3 } ^ { 2 – }\)
उत्तर:

प्रश्न 12.
निम्नलिखित यौगिकों के सूत्र लिखिए
- जिंक फॉस्फेट,
- अमोनियम ऑक्से लेट,
- मरक्यूरिक क्लोराइड,
- मरक्यूरस नाइट्रेट,
- एल्युमीनियम फ्लुओराइड,
- क्रोमियम क्लोराइड
- लेड ऐसीटेट,
- क्यूप्रस ऑक्साइड,
- कॉपर
- फॉस्फेट,
- निकिल नाइट्रेट
उत्तर:
- Zn3(PO4)2
- (NH4)2C2O4
- HgCl2
- Hg2(NO3)2
- AIF3
- CrCl3
- Pb (COOCH3)2
- Cu2O
- Cu3(PO4)2
- Ni(NO3)2
प्रश्न 13.
निम्नलिखित यौगिकों के नाम लिखिए
- Na2SO4,
- (NH4)2SO4
- Mn(OH)2
- NaOH
- ZnSO4
- COCl2
- KCIO3
- KBr
- FeCl3
- Al2O3
- (NH4)2 Cr2O7
- AgNO3
उत्तर:
- सोडियम सल्फेट
- अमोनियम सल्फेट
- मैंगनीज हाइड्रॉक्साइड
- सोडियम हाइड्रॉक्साइड
- जिंक सल्फेट
- कोबाल्ट क्लोराइड
- पोटैशियम क्लोरेट
- पोटैशियम ब्रोमाइड
- फेरिक क्लोराइड
- एल्युमीनियम ऑक्साइड
- अमोनियम डाइक्रोमेट
- सिल्वर नाइट्रेट।
निबन्धात्मक प्रश्न
प्रश्न 1.
अणुसूत्र से हमें क्या जानकारी प्राप्त होती है ?
उत्तर:
अणुसूत्र से हमें निम्न जानकारी प्राप्त होती है
- पदार्थ के रासायनिक नाम का पता चलता है, जैसे-KCl का पोटैशियम क्लोराइड है।
- यौगिक के अवयवी तत्वों के बारे में जानकारी प्राप्त होती है, जैसे-H2O में दो तत्व, हाइड्रोजन व ऑक्सीजन उपस्थित
- अणु में कुल परमाणुओं की संख्या की जानकारी मिलती है, जैसे-H2SO4 में दो परमाणु हाइड्रोजन, एक सल्फर व चार ऑक्सीजन परमाणु हैं।
- परमाणु भार ज्ञात होने पर अणुसूत्र से अणुभार ज्ञात किया जा सकता है।
प्रश्न 2.
आयनिक यौगिकों के गुण लिखिए।
उत्तर:
- प्रकृति-आयनिक यौगिक सामान्यत: क्रिस्टलीय ठोस, कठोर व भंगुर होते हैं।
- गलनांक व क्वथनांक-आयनिक क्रिस्टल में आवेशित आयनें के मध्य प्रबल आकर्षण बल होने के कारण इन्हें तोड़ने के लिये अधिक ऊर्जा की आवश्यकता होती है, अत: इनके गलनांक वे क्वथनांक सामान्यत: उच्च होते हैं।
- विलेयता- आयनिक यौगिक ध्रुवीय विलायकों (जैसे-जल) में विलेय होते हैं तथा अध्रुवीय विलायकों (जैसे- बैंजीन, ईथर) में अविलेय रहते हैं।
- चालकता-आयनिक यौगिक ऊष्मा के सुचालकं होते हैं तथा गलित अवस्था में विद्युत चालकता दशति हैं।
- आयनिक यौगिक आयनिक अभिक्रियाएँ प्रदर्शित करते हैं। जो तीव्र गति से होती हैं।
प्रश्न 3.
सह-संयोजक यौगिकों के गुण लिखिए।
उत्तर:
सह-संयोजक यौगिकों के गुण
- भौतिक अवस्था-ये यौगिक गैस, द्रव व ठोस तीनों अवस्थाओं में पाए जाते हैं। ये सामान्यत: मृदु होते हैं। (अपवाद : हीरा व रेत)
- गलनांक व क्वथनांक-सामान्यत: इनके गलनांक व क्वथनांक कम होते हैं।
- विलेयता-ये अध्रुवीय व कार्बनिक विलायकों में विलेय होते हैं।
- चालकता-ये विद्युत व ताप के कुचालक होते हैं। (अपवाद-ग्रेफाइट)
- सह-संयोजक यौगिक सामान्यतः आण्विक अभिक्रियाएँ करते हैं जो मंद गति से होती हैं।
प्रश्न 4.
रासायनिक समीकरण की विशेषताएँ लिखिए ?
उत्तर:
रासायनिक समीकरण की विशेषताएँ किसी अभिक्रिया के रासायनिक समीकरण से निम्नलिखित जानकारी मिलती है
- अभिक्रिया के क्रियाकारकों व क्रियाफलों के बारे में पता चलता है।
- रासायनिक समीकरण सन्तुलित होने पर क्रिया के अभिकारक व उत्पाद के अशुओं की संख्या की जानकारी प्राप्त होती है।
- समीकरण पदार्थों की संमतुल्य मात्राएँ दर्शाता है।
- यदि क्रियाकारक व उत्पाद गैसीय अवस्था में हों तो उनके आयतन का पता चलता है।
प्रश्न 5.
रासायनिक समीकरण की सीमाएँ लिखिए।
उत्तर:
- अभिकारक व उत्पाद की भौतिक अवस्था के बारे में समीकरण से कोई जानकारी नहीं मिलती है।
- अभिक्रिया के उत्क्रमणीय या अनुक्रमणीय होने का ज्ञान नहीं होता है।
- अभिक्रिया के ऊष्माक्षेप अथवा ऊष्माशोषी होने का पता नहीं लगता हैं।
- अभिक्रिया किस ताप और दाब पर होगी, इस बात की जानकारी नहीं मिलती है।
- अभिक्रिया की पूर्णता की जानकारी नहीं मिलती है।
प्रश्न 6,
रासायनिक समीकरण की कमियों को किस प्रकार दूर करते हैं ?
उत्तर:
रासायनिक समीकरण की कमियों को निम्न प्रकार से दूर किया जाता है
- भौतिक अवस्था प्रकट करने के लिये कोष्ठक में ठोस के लिये (s), द्रव के लिये (l) तथा गैस के लिये (g) लिखते हैं,
यथा-
\(\mathrm { CaCO } _ { 3 ( \mathrm { s } ) } \longrightarrow \mathrm { CaO } _ { ( s ) } + \mathrm { CO } _ { 2 ( \mathrm { g } ) }\). - उक्रमणीयता के लिये = प्रयुक्त करते हैं।
- ऊष्माशोषी अभिक्रिया के लिये ऋण (-) चिन्ह लगाकर और ऊष्माक्षेपी अभिक्रिया के लिये धन (+) चिन्ह लगाकर ऊष्मा की मात्रा लिखते हैं, यथा
\(\begin{array} { c } { \mathrm { SO } _ { 2 ( g ) } + \mathrm { O } _ { 2 ( g ) } \longrightarrow \mathrm { SO } _ { 3 ( g ) } + 694.6 \mathrm { kJ } } \\ { \mathrm { H } _ { 2 ( g ) } + \mathrm { I } _ { 2 ( g ) } \longrightarrow 2 \mathrm { HI } ( g ) – 53.6 \mathrm { kJ } } \end{array}\) - ताप च दाब प्रकट करने के लिये तीर के निशान पर उनकी मात्री लिखी जाती है, यथा–
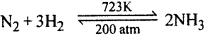
- उत्प्रेरक एवं अन्य जानकारी तीर के निशान के ऊपर एवं नीचे दर्शाते हैं।
प्रश्न 7.
निम्नलिखित अभिक्रियाओं को सन्तुलित करिए
(i) CH4Cl + Cl2 → CH3Cl + HCl
(ii) Ba(OH)2 +HBr → BaBr2 + H2O
(iii) BaCl2 + Al2 (SO)3 → AICI3 + BaSO4
(iv) BaCl2 + Na2SO4 → BaSO4 + NaCl
(v) KCIO3 → KCI + O2
उत्तर:
(i) 2CH4Cl + Cl2 → 2CH3Cl + HCl
(ii) Ba(OH)2 +2HBr → BaBr2 + 2H2O
(iii) 3BaCl2 + Al2 (SO)3 → 2AICI3 + 2BaSO4
(iv) BaCl2 + Na2SO4 → BaSO4 + 2NaCl
(v) 2KCIO3 → 2KCI + 3O2
We hope the given RBSE Solutions for Class 9 Science Chapter 4 रासायनिक बंध व रासायनिक समीकरण will help you. If you have any query regarding Rajasthan Board RBSE Class 9 Science Chapter 4 रासायनिक बंध व रासायनिक समीकरण, drop a comment below and we will get back to you at the earliest.